オルガネラを介した新規酸素センサーの発見
―腫瘍悪性化に関与するがん促進性免疫細胞の代謝制御機構―
- プレスリリース
2023年10月3日
東京大学
発表のポイント
- 低酸素は骨髄由来細胞においてゴルジ体崩壊を介したコレステロール合成経路(SREBP2活性化)を誘導し、がん促進性免疫細胞の腫瘍内への浸潤と血管新生を介してがんの増殖を亢進することを発見しました。
- コレステロール合成経路のマスターレギュレーターであるSREBP2の酸素センサーとしての役割を哺乳類細胞で初めて発見しました。
- コレステロール合成経路を標的としたがん促進性免疫細胞の阻害や、オルガネラを標的とした新たながん治療法の開発への応用が期待されます。
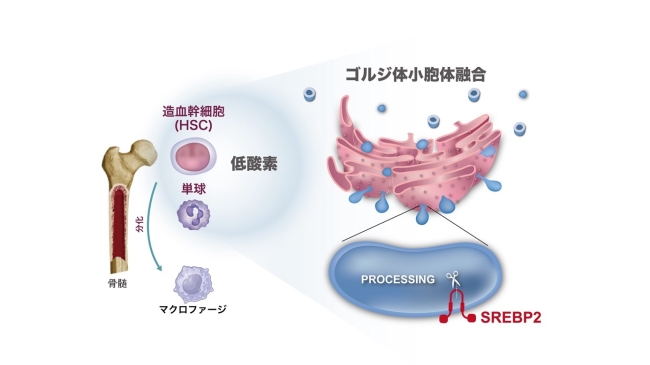
腫瘍悪性化に関与するオルガネラを介した酸素センサーとしてのSREBP2の役割を哺乳類細胞で初めて発見
発表概要
骨髄由来の免疫細胞は低酸素状態のがん組織内に浸潤し、腫瘍血管新生とがんを促進する免疫細胞を活性化することが知られていますが、低酸素が骨髄由来の免疫細胞の活性をどのように制御するかはこれまで不明でした。
東京大学先端科学技術研究センターの大澤 毅 准教授、安藝 翔 特任助教、菅谷 麻希 学術専門職員、同大学大学院工学系研究科化学生命工学専攻の中原 龍一 大学院生らによる研究グループは、東京医科歯科大学難治疾患研究所、名古屋大学大学院医学系研究科、東北大学大学院医学系研究科、福井大学大学院医学系研究科やがん研究会がん研究所の研究グループと共同で、低酸素が誘導する、細胞内小器官の一つであるゴルジ体の崩壊を伴うゴルジ体と小胞体の融合がコレステロール合成経路を活性化することを見出し、オルガネラ(注1)を介したがん促進性の免疫制御機構が、がんの進展に関与することを発見しました。また、コレステロール合成経路のマスターレギュレーター(主要転写制御因子)である SREBP2(注2)の酸素センサーとしての役割を哺乳類細胞(ヒト細胞)で初めて報告しました(図1)。本研究成果は、コレステロール合成経路を標的としたがん促進性免疫細胞やオルガネラを標的とした新たながん治療法の開発への応用が期待されます。
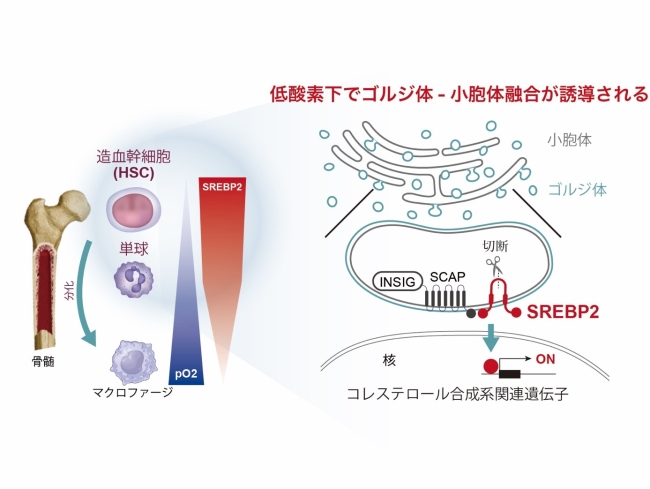
本研究成果は、2023年10月2日正午(米国東部夏時間)に電子ジャーナル「The EMBO Journal」に掲載されました。
発表内容
骨髄由来の免疫細胞BMDCs(注3)は、初期の低酸素状態のがん組織に浸潤し、マクロファージ(注4)に分化することにより、腫瘍促進免疫を誘導することが知られています。研究グループは、骨髄由来の免疫細胞におけるトランスクリプトーム(注5)、エピゲノム(注6)、およびメタボローム(注7)の網羅的 オミクス統合解析(注8)から、腫瘍微小環境の一つである低酸素というがん細胞を取り巻く環境が、骨髄由来の免疫細胞のコレステロール合成経路を誘導することを発見しました。また、低酸素により一部の骨髄由来の免疫細胞のゴルジ体が崩壊し、さらに、崩壊したゴルジ体と小胞体が融合することで、コレステロール合成経路のマスターレギュレーターであるSREBP2が、酸素を感知して活性する新たなメカニズムを発見しました(図1)。
造血幹細胞の一部は、単球からマクロファージ細胞へと分化(分化マーカーCD11b、CD35、CD32)することが知られていますが、低酸素の単球でのみゴルジ体の崩壊に伴ってSREBP2が活性化し、SREBP2の標的であるコレステロール合成酵素(HMGCS1、HMGCR、LSS、MSMO1など)の遺伝子発現が上昇しました(図2)。
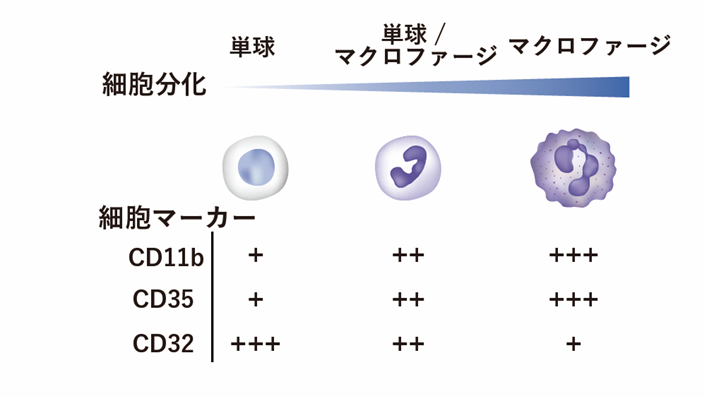
造血幹細胞の一部は、単球からマクロファージ細胞へと分化(分化マーカーCD11b、CD35、CD32)することが知られている。本研究では、単球細胞株やマクロファージ細胞株、および分化誘導剤を用いた単球からマクロファージ細胞への分化系や骨髄由来細胞を用いて解析を行った。
注目すべきことに、低酸素によるSREBP2の活性化は、単一細胞解析の結果から骨髄由来の未成熟な免疫細胞系でのみ観察され、コレステロール合成経路が骨髄由来の免疫細胞の分化調節に関与することが示唆されました(図1)。
本研究では、単球細胞株やマクロファージ細胞株、および分化誘導剤を用いた単球からマクロファージ細胞への分化系や骨髄由来細胞を用いて解析を行いました(図2)。はじめに、常酸素と低酸素で培養した単球細胞、単球/マクロファージ細胞やマクロファージ細胞におけるコレステロール合成経路の酵素(HMGCS1、HMGCR、LSS、MSMO1など)の遺伝子発現を調べたところ、単球細胞は低酸素においてコレステロール合成酵素の遺伝子発現を増加することを見出しました(図3)。次に、骨髄由来の細胞のシングルセル解析の結果、造血幹細胞や単球細胞のコレステロール合成経路が増加しました(図4)。また、低酸素下の単球細胞ではゴルジ体が崩壊し、SREBP2が核内移行し活性化されることが観察されました(図5)。さらに、コレステロール合成経路の阻害により、がん促進性の免疫細胞の浸潤、血管新生、および腫瘍増殖が抑制されたことから、コレステロール合成経路を標的とした新たながん治療法の開発への応用が期待されます。
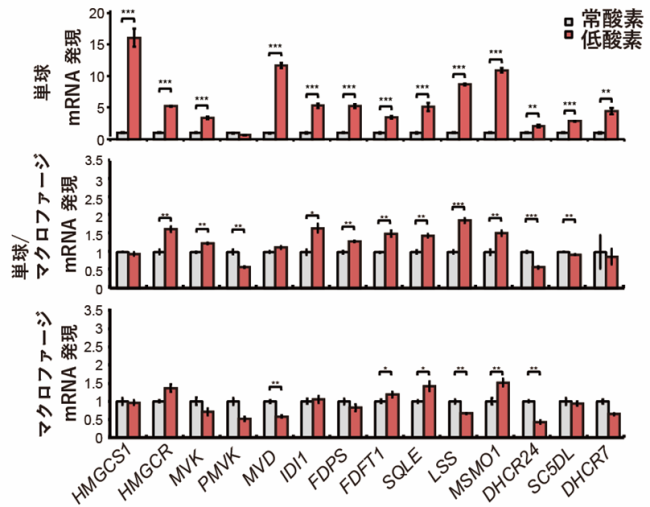
常酸素と低酸素で培養した単球細胞、単球/マクロファージ細胞やマクロファージ細胞におけるコレステロール合成経路の酵素(HMGCS1、HMGCR、LSS、MSMO1など)の遺伝子発現を調べた。
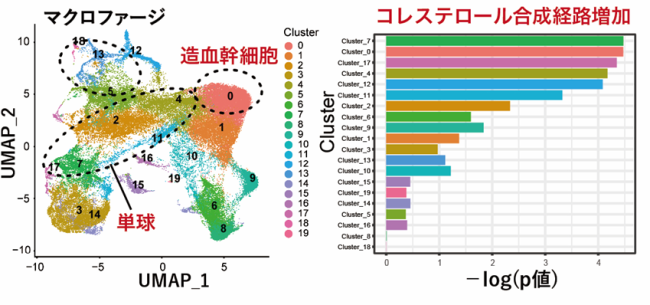
骨髄由来の細胞のシングルセル解析の結果、造血幹細胞や単球細胞のクラスター(Cluster0,7,17,4など)でコレステロール合成経路が増加した。
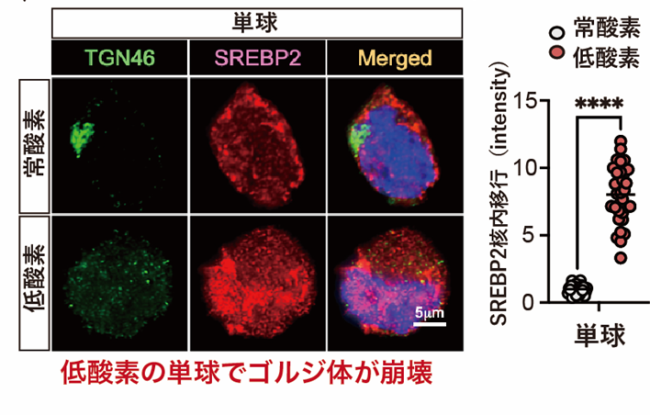
低酸素下の単球細胞でゴルジ体(TGN46陽性)が崩壊し、SREBP2が核内移行し活性化された。
本研究は、ゴルジ体の崩壊を伴う新規酸素センサーSREBP2の活性化が、がん促進性免疫細胞の分化を調節することで、がんの進展に関与するという新しい代謝調節機構の発見に繋がりました。本研究にて得られた知見から、コレステロール合成系を標的とした腫瘍免疫系の阻害や、オルガネラを標的とした新たながん治療法の確立が期待されます。
発表者
東京大学
先端科学技術研究センター ニュートリオミクス・腫瘍学分野
大澤 毅(准教授)
安藝 翔(特任助教)
菅谷 麻希(学術専門職員)
大学院工学系研究科 化学生命工学専攻
中原 龍一(博士課程)
論文情報
- 雑誌:
- The EMBO Journal(10月2日)
- 題名:
- Hypoxia activates SREBP2 through Golgi disassembly in bone marrow-derived monocytes for enhanced tumor growth.
- 著者:
- Ryuichi Nakahara, Sho Aki, Maki Sugaya, Haruka Hirose, Miki Kato, Keisuke Maeda, Daichi M. Sakamoto, Yasuhiro Kojima, Miyuki Nishida, Ritsuko Ando, Masashi Muramatsu, Melvin Pan, Rika Tsuchida, Yoshihiro Matsumura, Hideyuki Yanai, Hiroshi Takano, Ryoji Yao, Shinsuke Sando, Masabumi Shibuya, Juro Sakai, Tatsuhiko Kodama, Hiroyasu Kidoya, Teppei Shimamura, and Tsuyoshi Osawa.
- DOI:10.15252/embj.2023114032
研究助成
本研究は、国立研究開発法人日本医療研究開発機構(AMED)「次世代がん医療加速化研究事業(P-PROMOTE)」、科研費「基盤B(課題番号:19H03496)」、「新学術領域研究(課題番号:20H04834)」、「挑戦的萌芽(課題番号:19K22553, 21K19399, 23K18234)」、「AdAMS (課題番号:22H04922)」、日本学術振興会特別研究員奨励費(課題番号:22J13979, 23KJ0581)、東京大学大学院工学系研究科「リーダー博士人材育成基金」特別助成プログラムや住友財団、島津財団、倉田財団、内藤財団、山田科学財団、上原財団、小柳財団、武田財団、SGH財団などの支援を得て行われました。
用語解説
関連タグ


ミトコンドリア、ゴルジ体、小胞体などの細胞内小器官を指す。各オルガネラは特定の生化学的プロセスや細胞の機能に関与し、それぞれが特有の役割を有している。
コレステロール合成を制御する転写因子。コレステロール生合成経路酵素群の転写を亢進し酵素群の発現を上昇させる。
骨髄は主に骨の中に存在し、造血幹細胞や多くの異なる種類の細胞の発生の場である。骨髄由来細胞はマクロファージなどの免疫系や、赤血球、白血球など血液形成に重要な役割を果す。
体内に侵入した細菌などの異物を食べ消化・殺菌するなど、細菌感染を防ぐ自然免疫において重要な役割を担う免疫細胞。
特定の状況下での細胞内の全転写産物(全RNA)のこと。細胞内の全DNAの塩基配列情報であるゲノムは原則として同一個体内のすべての細胞で同一だが、トランスクリプトームは各細胞や条件で異なる。
DNAのメチル化とヒストン修飾で維持・伝達される、後天的に書き換えられる遺伝情報。エピゲノムの変化が、トランスクリプトームの変化を引き起こすことが知られている。
分析装置で計測された代謝物を網羅的に一斉解析する手法。生体中の代謝物質の総体(メタボローム)を包括的に解析することができる。
生体内の分子群(DNAやRNA、タンパク質、代謝物、脂質等)を網羅的に解析することで生命現象を包括的に調べる手法を『オミクス解析』と呼ぶ。このオミクス解析から得られた多階層の情報を統合して解析する方法。
問合せ先
東京大学 先端科学技術研究センター ニュートリオミクス・腫瘍学分野
准教授 大澤 毅(おおさわ つよし)