シングルセル解析と機械学習により心不全において心筋細胞が 肥大化・不全化するメカニズム(心筋リモデリング機構)を解明
- プレスリリース
2018年10月30日
1.発表者:
- 小室 一成
- (東京大学医学部附属病院 循環器内科/東京大学大学院医学系研究科 教授)
- 油谷 浩幸
- (東京大学先端科学技術研究センター ゲノムサイエンス分野 教授)
- 野村 征太郎
- (東京大学医学部附属病院 循環器内科/東京大学大学院医学系研究科 重症心不全治療開発講座 特任助教)
- シングルセル解析により世界で初めて心不全発症における心筋リモデリング(環境に合わせて細胞の性質が変わること)の分子プロファイルの挙動を明らかにしました。
- 心臓への病的負荷により誘導された肥大心筋は代償性心筋・不全心筋へと分岐すること、不全心筋への誘導にはp53シグナルの活性化が重要であることを解明しました。
- 心不全患者のシングルセル解析により患者の予後予測・分子病態の層別化につながる遺伝子発現プロファイルを明らかにし、精密医療の実現を近づけました。
心不全(注1)はがんと並び世界中で多くの患者の命を脅かしています。心臓に高血圧や大動脈弁狭窄症のような血行力学的負荷がかかると、代償的に心臓は肥大してポンプ機能を維持しようとしますが、慢性的な負荷は壁運動低下・心拡大を引き起こし、心不全を発症します。その過程で心筋細胞の肥大化と不全化が中心的な役割を担っていると考えられていますが、その詳細な分子メカニズムは明らかでなく、心不全の分子病態を把握・治療する有効な手法は存在しません。
東京大学医学部附属病院 循環器内科の小室一成教授、野村征太郎特任助教、先端科学技術研究センターの油谷浩幸教授らは、心不全モデルマウスおよび心不全患者の心臓から心筋細胞を単離した後、細胞集団ではなく個々の細胞を解析できるシングルセル解析(注2)によりトランスクリプトーム(全遺伝子発現情報)を取得し、機械学習(注3)により世界で初めて心筋細胞リモデリング(環境に合わせて細胞の性質が変わること)の過程における分子プロファイルの挙動を明らかにしました。その結果、心筋細胞の肥大化にはミトコンドリア生合成の活性化が重要であること、肥大心筋細胞は代償性心筋細胞と不全心筋細胞へと分岐すること、不全心筋細胞への誘導にはがん抑制遺伝子であるp53の活性化による代謝・形態リモデリングが重要であることを明らかにしました。さらに、心筋遺伝子の発現応答はマウスとヒトで極めて良く保存されていることを確認し、心不全に特徴的な遺伝子の発現パターンから患者の予後を予測し病態を層別化できることを実証しました。これらの成果は、心臓疾患の詳細な病態解明に役立つだけでなく、個々の心不全患者の臨床像と連結した分子病態の理解に直結し、循環器疾患における精密医療の実現に貢献するものと期待されます。
本研究は日本医療研究開発機構(AMED)革新的先端研究開発支援事業「心筋メカノバイオロジー機構の解明による心不全治療法の開発(研究代表者:小室一成)」、日本学術振興会 科学研究費助成事業 基盤研究A「心不全発症における心筋細胞不均一性の意義(研究代表者:小室一成)」、日本循環器学会 基礎研究助成「心臓細胞分子アトラスによる心臓疾患の病態解明および精密医療の実現(研究代表者:野村征太郎)」等の支援により行われ、日本時間10月30日に英国の科学雑誌Nature Communicationsにて発表されました。
<研究の背景>
心臓は常に血行力学的な負荷を受け、それに対応しながら全身の循環恒常性を保っています。高血圧や大動脈弁狭窄症のような圧負荷に対して、心臓は肥大して代償しようとしますが、慢性的な圧負荷は壁運動低下・心拡大を引き起こし、心不全を誘導します。この過程において、心臓ポンプ機能の中心的な役割を担っている心筋細胞は、最初は代償的に肥大(短径の増加)しますが、長期的な負荷により伸長(長径の増加)を伴った収縮力低下を示します。しかし圧負荷によって心筋細胞の肥大化や不全化がどのように導かれるか明らかではありませんでした。
<研究内容>
① 圧負荷心不全モデルマウスのシングルセル解析で心筋リモデリング過程を詳細に解明
研究グループは、横行大動脈を縮窄することで心臓に圧負荷を加えて心肥大(術後1-2週)・心不全(術後4-8週)を誘導するマウスをモデルに、心筋細胞の形態的・分子的特徴が心臓機能とどのように関連するかを調べました。圧負荷3日後、1・2・4・8週後および偽手術後のマウスの心筋細胞を単離してシングルセル解析からトランスクリプトーム(全遺伝子発現情報)を取得してMonocle(注4)というアルゴリズムで機械学習を行ったところ、圧負荷により肥大心筋細胞が代償性心筋細胞と不全心筋細胞へと分岐して心筋リモデリングが進むことが明らかとなりました(図1)。
② 心筋細胞の肥大化・不全化を誘導するシグナルを同定
続いて心肥大(術後1週)のマウスから心筋細胞を単離し、細胞サイズを測定後にその細胞のシングルセル解析を行ったところ、心筋細胞の肥大の程度はミトコンドリア機能を制御する遺伝子群の発現量と相関することがわかりました。さらにエピゲノム解析(注5)で上流転写因子・シグナルを解析したところ、細胞増殖に関係するERK1/2シグナル、ミトコンドリア生合成を制御するNRF1/2シグナルが肥大心筋細胞を誘導していることがわかりました(図1)。 さらに肥大期後半の心筋細胞の遺伝子ネットワーク解析を行ったところ、肥大心筋細胞から不全心筋細胞への誘導に関わる因子としてがん抑制遺伝子であるp53が同定されたため、心筋細胞特異的にp53を欠損するノックアウトマウス(p53CKOマウス)を作成して圧負荷後の心機能解析を行いました。すると、圧負荷を誘導してもこのマウスは心肥大を呈するものの不全心筋細胞は出現せず、心不全は発症しませんでした。つまりp53シグナルが不全心筋細胞の誘導シグナルであることを明らかにしました(図1)。
③ シングルセル解析の臨床応用
本研究で構築してきた心筋のシングルセル解析技術を心不全患者の心臓病態解析に応用しました。拡張型心筋症(Dilated cardiomyopathy, DCM)(注6)患者が左室補助人工心臓(Left Ventricular Assist Device, LVAD)(注7)の植込み術を受ける際に心臓組織から心筋細胞を単離してtSNE(注8)という機械学習アルゴリズムでシングルセル解析を行ったところ、健常者の心筋細胞はひとつの細胞集団に集まっている一方で、DCM患者の心筋細胞は複数の細胞集団に分類され、DCM心筋細胞は不均一性が大きいことがわかりました(図2A)。そしてマウスとヒトの間の種を超えた保存性のある心不全関連遺伝子群を2種類同定し(M1: DNAダメージ関連遺伝子群、M2: ミトコンドリア関連遺伝子群)、DCM患者のLVAD植込み術後の心機能の改善の程度とM1/M2の心筋遺伝子発現プロファイルの関係性を解析したところ、M1/M2遺伝子発現が高い心筋細胞を有する患者ではLVAD植込み術後の心機能の改善がみられない一方、M1/M2遺伝子発現が低い心筋細胞を有する患者は健常者と同様の遺伝子発現パターンであり心筋細胞の機能回復を起こす可能性があることを見出しました(図2B)。これは、心筋遺伝子発現パターンにより心筋細胞の可逆性を評価できることを示唆しています。
<社会的意義>
本研究は、心不全の発症過程における心筋細胞リモデリングのシングルセル解析を通して、心筋肥大にはERK1/2・NRF1/2シグナルによるミトコンドリア遺伝子の発現活性化が、不全心筋誘導にはp53シグナル活性化に伴った代謝・形態リモデリングが重要であることを明らかにしました。心筋細胞の根本原理を解き明かしたこれらの知見は心臓疾患の理解に大きく貢献するだけでなく、本研究が生み出したシングルセル解析技術は今後さまざまな心臓分子病態の解析に応用されることが期待されます。また本研究は、心筋遺伝子発現応答を基にした心不全患者の分子病態層別化の可能性を実証しており、循環器疾患における精密医療の実現に貢献するものと期待されます。
5.発表雑誌:
雑誌名:Nature Communications (オンライン版:英国時間10月30日)
論文タイトル:Cardiomyocyte gene programs encoding morphological and functional signatures in cardiac hypertrophy and failure
著者:Seitaro Nomura*, Masahiro Satoh, Takanori Fujita, Tomoaki Higo, Tomokazu Sumida, Toshiyuki Ko, Toshihiro Yamaguchi, Takashige Tobita, Atsuhiko T. Naito, Masamichi Ito, Kanna Fujita, Mutsuo Harada, Haruhiro Toko, Yoshio Kobayashi, Kaoru Ito, Eiki Takimoto, Hiroshi Akazawa, Hiroyuki Morita, Hiroyuki Aburatani*, Issei Komuro*
DOI番号:10.1038/s41467-018-06639-7
6.問い合わせ先:
<研究内容に関するお問い合わせ先>
東京大学医学部附属病院 循環器内科
教授 小室 一成(こむろ いっせい)
循環器内科/重症心不全治療開発講座
特任助教 野村征太郎(のむら せいたろう)
東京大学先端科学技術研究センター ゲノムサイエンス分野
教授 油谷 浩幸(あぶらたに ひろゆき)
<取材に関するお問い合わせ先>
東京大学医学部附属病院 パブリック・リレーションセンター
(担当:渡部、小岩井)
東京大学先端科学技術研究センター
広報・情報室(担当:村山)
<AMED事業に関するお問い合わせ先>
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
7.用語解説:
(注1)心不全:なんらかの心臓機能障害、すなわち、心臓に器質的および/あるいは機能的異常が生じて心ポンプ機能の代償機転が破綻した結果、呼吸困難・倦怠感や浮腫が出現し、それに伴い運動耐容能が低下する臨床症候群
(注2)シングルセル解析(Single-cell RNA sequencing):ひとつの細胞に含まれる全てのメッセンジャーRNAから逆転写反応によりcDNAを作成してPCRにより増幅した産物を次世代シークエンサーにより読み取ることで、ひとつの細胞に含まれる全遺伝子の発現量を定量解析する手法。
(注3)機械学習:人工知能における研究課題の一つで、大量のデータをもとに物体の認識や事柄のグループ分けなどの作業をコンピュータ上で実現する技術。本研究ではシングルセルの全遺伝子発現データをもとに細胞がどのように変化したかを予測するアルゴリズムを用いて心筋リモデリング過程における分子プロファイルの挙動を同定した。
(注4)Monocle:機械学習アルゴリズムの一つで、シングルセル解析により得られた遺伝子発現情報を用いてPseudotimeと呼ばれる擬似的な時間軸を作り出し細胞系譜を予測する解析アルゴリズム(Qiu et al, Nat Methods 2017)。
(注5)エピゲノム解析:遺伝子制御領域(エンハンサーやプロモーター)を全ゲノムから網羅的に抽出する解析手法。遺伝子群の上流転写因子を決定するために利用される。
(注6)拡張型心筋症:心筋細胞の機能障害により心臓の収縮力が低下して心不全を呈し、場合によっては左室補助人工心臓や心臓移植が必要となる疾患。
(注7)左室補助人工心臓:心不全に陥った心臓の代替として、血液循環のためのポンプ機能を補う治療用装置。
(注8)tSNE(t-distributed Stochastic Neighbor Embedding):データの特徴を保持したまま高次元から 2 または 3 次元への非線形削減を行うことによりデータを可視化する機械学習解析アルゴリズム(van der Maaten et al. J. Mach. Learn. Res. 2008)。
(注9)WGCNA(Weighted Gene Co-expression Network Analysis、重み付け遺伝子共発現ネットワーク解析):データセットから共発現遺伝子ネットワークを抽出し、そのネットワークモジュールごとに発現値を付与する機械学習解析アルゴリズム(Langfelder, P et al. BMC Bioinformatics 2008)。
8.添付資料:
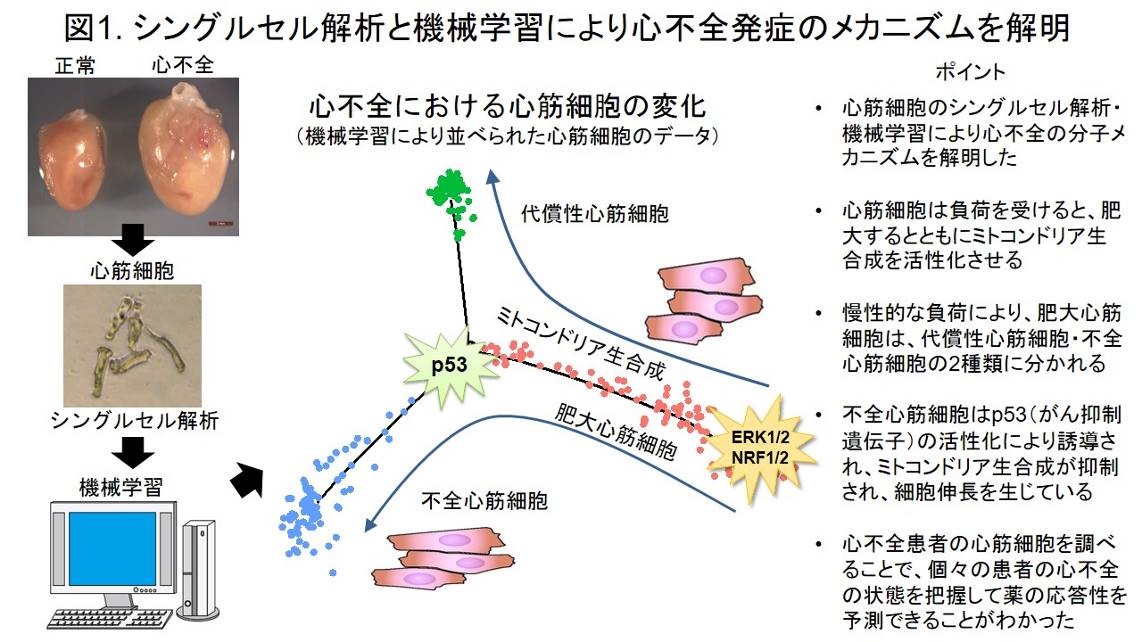
中央の図はMonocle(注4)によりPseudotimeに沿って並べられたシングルセル情報。ERK1/2・NRF1/2シグナルによって誘導された肥大心筋細胞(赤)はミトコンドリア生合成を活性化させているが、慢性的な負荷により代償性心筋細胞(緑)と不全心筋細胞(青)へと分岐する。不全心筋細胞はp53シグナルの活性化によって誘導され、代償性心筋細胞と異なりミトコンドリア生合成は不活化し、細胞は伸長している。
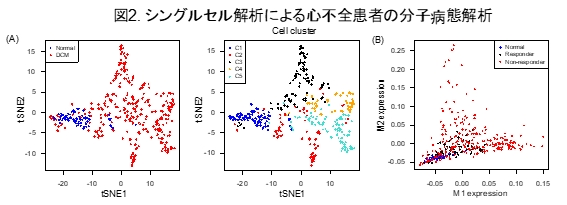
(A)ヒト健常者とDCM患者のシングルセル解析。tSNE(注8)により次元削減を行い、細胞間の関係性を二次元空間上に可視化。DCM患者の心筋細胞は不均一性が高い。右図はクラスタリング解析により分類された細胞クラスター(C1-5)で色付けした。 (B)心不全関連遺伝子群M1/M2と臨床像の関連付け解析。ひとつのドットがひとつの細胞の発現状態を示している。M1/M2の発現値はWGCNA(注9)により算出した。Responder(LVAD植込みにより心機能改善するDCM患者)とNormal(健常者)の心筋細胞ではM1/M2遺伝子発現が低い一方で、Non-responder(LVAD植込みにより心機能改善しないDCM患者)ではこれらの遺伝子を強く発現する細胞が含まれている。
関連タグ

