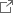自然免疫応答を活性化する新たな自己RNAを同定
— 自己免疫疾患、炎症性疾患の原因解明、治療薬開発に期待 —
- プレスリリース
2019年11月5日
- 根岸 英雄
- (研究当時:東京大学生産技術研究所 炎症・免疫制御学 社会連携研究部門 特任助教、現在:同医科学研究所 感染・免疫部門 ワクチン科学分野 特任講師)
- 遠藤 信康
- (研究当時:東京大学生産技術研究所 炎症・免疫制御学 社会連携研究部門 博士課程、現在:アステラス製薬)
- 谷口 維紹
- (東京大学名誉教授、研究当時:同生産技術研究所 炎症・免疫制御学 社会連携研究部門 特任教授、現在:同先端科学技術研究センター 炎症疾患制御分野社会連携研究部門 客員研究員)
- 自己RNAによる応答を抑制する新規化合物を開発し、その新規化合物の結合RNAの中から、新しい内在性のTLR7(注1)リガンドとしてU11snRNA(注2)を同定し、同RNAがヒト自己免疫患者および自己免疫疾患モデルマウスにおいて、病態と相関して血中で増加すること、非常に強いTLR7リガンド活性を有することを明らかにした。
- U11snRNAの強いTLR7リガンド活性のメカニズムを解明し、その原理を応用して新規TLR7アンタゴニスト、新規TLR7アゴニストを開発した。
- RNA受容体(TLR7)が関与するとされるさまざまな自己免疫疾患や炎症性疾患のメカニズム解明や、これら疾患に対する創薬の手掛かりになることが期待される。
東京大学の谷口維紹名誉教授、生産技術研究所 根岸英雄特任助教(研究当時、現 医科学研究所 特任講師 )らの研究グループは、自己の細胞に由来し、生体に不利益な自然免疫応答を活性化するRNAを同定しました。さまざまな自己免疫疾患や炎症性疾患にRNA受容体を介した自然免疫応答が関与することが知られていましたが、その原因となるRNAリガンドについては良く分かっていませんでした。
本研究グループは、自然免疫応答の制御機構の解明と制御法の開発を推進しており、その中で、RNAに直接結合し、そのRNA受容体リガンドとしての活性を阻害する低分子化合物を開発することに成功しました。この化合物がマウスモデルで自己免疫疾患の病態を抑制できることを見出したため、さらに化合物に結合する内在性のRNAを網羅的に同定したところ、それらの中から自己免疫疾患患者の血清中で、病気の程度と相関して増加するRNAとして、U11snRNAという低分子RNAを同定しました。興味深いことに、このU11snRNAはこれまで知られていた自己に由来するRNAと比較して、RNA受容体に対する強いリガンド活性を有することが判明しました。また、本研究グループはU11snRNAの強いリガンド活性のメカニズムを解明し、その原理を元に、RNA受容体を強力に活性化するアゴニスト、および抑制アンタゴニストの作成にもそれぞれ成功しました。
これらの発見、成果は、RNA受容体が関与するさまざまな疾患の発症や増悪のメカニズム解明に繋がることが期待されます。また、化合物やアンタゴニストは、RNA受容体の関与する疾患の治療薬として、アゴニストは感染症やがんに対するワクチンの効果を高めるアジュバントとしての開発がそれぞれ期待されます。
本研究は、主に東京大学生産技術研究所(谷口維紹研究室(研究当時))および先端科学技術研究センターにて行われたもので、山本一彦チームリーダー(理化学研究所生命医科学研究センター)、藤尾圭志教授(東京大学医学部付属病院) 、興和株式会社との共同で行ったものです。
本研究成果は、2019年11月4日(米国東部時間)に米国科学誌「PNAS」のオンライン速報版で公開されました。
本成果は、主に以下の事業・研究領域・研究課題によって得られました。
日本医療研究開発機構(AMED)
研究領域:難治性疾患実用化研究事業
研究課題名:免疫活性化分子の標的薬剤による全身性エリテマトーデス、多発性硬化症の病態抑制機構の解明と治療法の確立
研究代表者:谷口 維紹
研究期間:平成27年度~平成29年度
日本医療研究開発機構(AMED)
研究領域:難治性疾患実用化研究事業
研究課題名:内在性炎症性RNA分子による全身性エリテマトーデスの病態発症・増悪機構の解明とその機構を標的とした治療法の確立
研究代表者:根岸 英雄
研究期間:平成30年度~令和2年度
<研究の背景と経緯>
免疫細胞にはさまざまなパターン認識受容体(Toll様受容体(TLR)、RIG-I様受容体(RLR)、NOD様受容体(NLR)など)が発現しており、病原体に対する免疫応答の活性化に重要な役割を果たしています。一方で、このパターン認識受容体が自己の細胞に由来する成分によって活性化することが病気の発症や増悪に寄与することも知られています。特にパターン認識受容体の中でも一本鎖RNA(ssRNA)を認識する受容体であるTLR7が、さまざまな自己免疫疾患や炎症性疾患に関与することが知られています。しかしながら、TLR7を介して不利益な免疫応答を活性化する自己の細胞由来のRNAについては、その実態が不透明なままでした。
<研究内容>
本研究グループは、自然免疫応答の制御機構の解明と制御法の開発を推進してきました。その中で、RNAに直接結合し、そのRNA受容体リガンドとしての活性を阻害する低分子化合物KN69を開発することに成功しました。さらにKN69がマウスモデルで自己免疫疾患の病態を抑制できることを見出したため、KN69に結合する内在性のRNAを網羅的に同定し、これらRNAの中から自己免疫疾患の病態と関連するRNAを探索しました。その結果、RA(注3)およびSLE(注4)患者の血清中で、病気の程度と相関して増加するRNAとして、U11snRNAという低分子RNAを同定しました。興味深いことに、このような血清中での増加は、解析したRNAの中でU11snRNAに特異的に起こる現象であり、U11snRNAの血中量は、IFN シグネチャー (注5)と呼ばれる自己免疫疾患に特徴的な遺伝子群の発現上昇とも相関することも分かりました。さらに、このU11snRNAはこれまで知られている自己に由来するRNAと比較して、RNA受容体に対する強いリガンド活性を有することが判明し、マウスへの投与で関節炎を誘導することも分かりました。また、本研究グループはU11snRNAの強いリガンド活性のメカニズムを解明し、その原理を元に、RNA受容体を強力に活性化するアゴニスト(SM-PS)、または抑制するアンタゴニスト(SM-MePS)の作成にもそれぞれ成功しました。
<今後の展開>
これらの発見、成果は、RNA受容体が関与するさまざまな疾患の発症や増悪のメカニズム解明に繋がることが期待されます。また、化合物やアンタゴニストは、RNA受容体の関与する疾患の治療薬として、アゴニストは感染症やがんに対するワクチンの効果を高めるアジュバントとしての開発がそれぞれ期待されます。
雑誌名:「Proceedings of the National Academy of Sciences USA (PNAS)」
論文タイトル:Identification of U11snRNA as an endogenous agonist of TLR7-mediated immune pathogenesis
著者:Hideo Negishi, Nobuyasu Endo, Yuki Nakajima, Tatsuaki Nishiyama, Yuichiro Tabunoki, Junko Nishio, Ryuji Koshiba, Atsushi Matsuda, Kosuke Matsuki, Tomohisa Okamura, Takako Negishi-Koga, Takeshi Ichinohe, Shunji Takemura, Hiroyuki Ishiwata, Shun-ichiro Iemura, Tohru Natsume, Takaya Abe, Hiroshi Kiyonari, Takeshi Doi, Sho Hangai, Hideyuki Yanai, Keishi Fujio, Kazuhiko Yamamoto and Tadatsugu Taniguchi*
東京大学 先端科学技術研究センター 炎症疾患制御分野社会連携研究部門
客員研究員 谷口 維紹(タニグチ タダツグ)
東京大学 医科学研究所 感染・免疫部門 ワクチン科学分野
特任講師 根岸 英雄(ネギシ ヒデオ)
- (注1)TLR7:Toll-like receptor 7の略。一本鎖RNAを認識して免疫応答を活性化する受容体。
- (注2)U11snRNA:U11 small nuclear RNAの略。RNAのスプライシングを行うスプライソソームの一つであるマイナースプライソソームの主要な構成RNA。
- (注3)RA:関節リウマチの略。
- (注4)SLE:全身性エリトマトーデスの略。
- (注5)IFN シグネチャー :SLEなどの自己免疫疾患で見られる症状で、I型インターフェロン(IFN)と呼ばれる免疫調節因子や、I型インターフェロンの影響を受ける遺伝子群の発現が上昇する現象。
- (注6)U1snRNA:U1 small nuclear RNAの略。RNAのスプライシングを行うスプライソソームの一つであるメジャースプライソソームの主要な構成RNA。
A. マウス脾臓細胞を一本鎖RNAで刺激し、図に示したmRNAの発現を定量的RTPCR法によって解析した。この際、KN69を培地に添加すると濃度依存的にmRNAの発現が抑制された。B.C. 関節炎モデルマウス(B)またはGVHDループス腎炎モデルマウス(C)において、KN69の薬効を検証した。KN69の経口投与によってそれぞれの病態モデルに特徴的な症状が顕著に抑制された。
**:p<0.01、***:p<0.001、N.S.:not significant
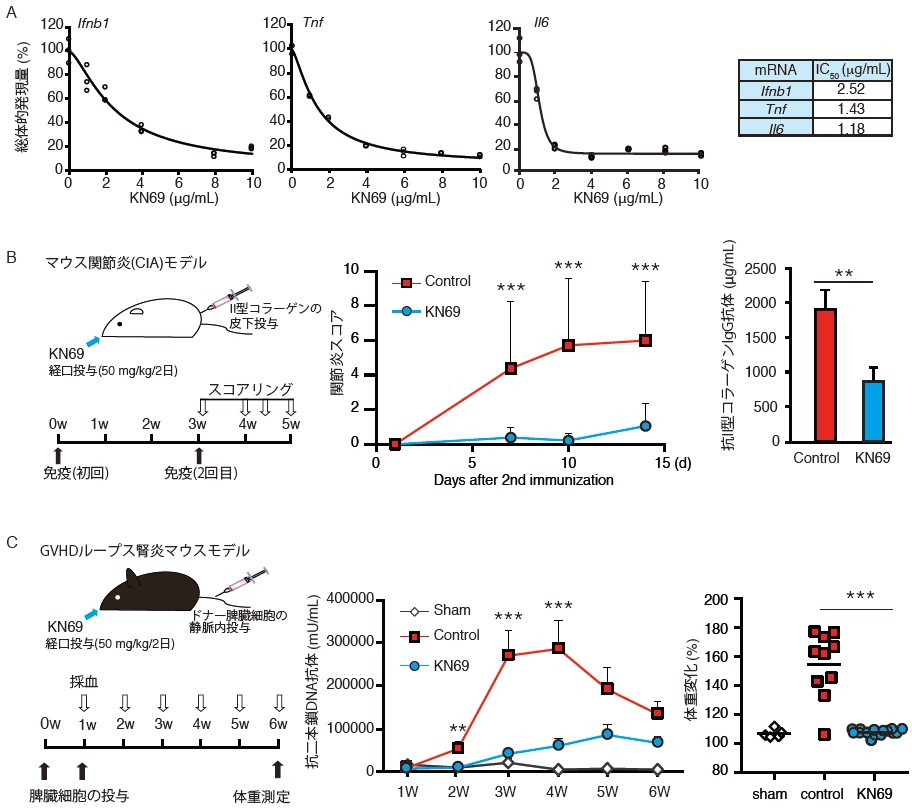
A.B. 関節炎モデルマウス(A)またはSLEモデルマウス(B)から採取した血清中のU11snRNA、U1snRNA(注6)の相対量を定量的RTPCR法によって解析した。各疾患モデルマウス由来の血清中でU11snRNAの増加が観察された。C-F. RA患者またはSLE患者由来の血清中におけるU11snRNA、U1snRNAの相対量を定量的RTPCR法によって解析した。各患者由来の血清中でU11snRNAの増加が観察された(C.E)。また、血清中のU11snRNAおよびU1snRNAの相対量と病態との関係について解析した結果、血清中のU11snRNA相対量は病状の重い患者に由来する血清において、より高い値を示す傾向にあった(D.F)。
*:p<0.05、**:p<0.01、N.S.:not significant
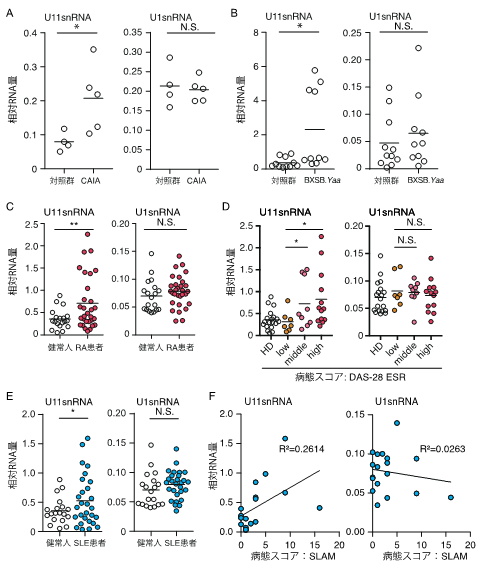
A. マウス脾臓細胞を図に示した各RNAで刺激し、各mRNAの発現を定量的RTPCR法によって解析した。U11snRNAは他のRNAと比較して強力な遺伝子誘導能を示した。B. マウス脾臓細胞をU11snRNAで刺激し、各mRNAの発現を定量的RTPCR法によって解析した。U11snRNAによる遺伝子発現はKN69の添加によって濃度依存的に抑制された。C. マウスの膝関節にU11snRNAを投与し、膝関節の腫れを継時的に測定した。U11snRNAの投与は関節炎を引き起こし、この関節炎はKN69の投与によって抑制された。
***:p<0.001、N.S.:not significant
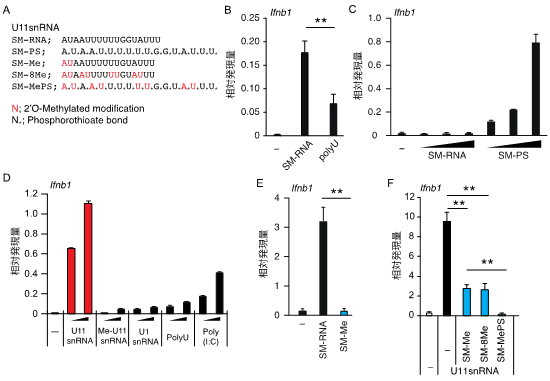
A.U11snRNAの配列を基に作成した一本鎖RNAの配列と修飾構造のまとめ図。B-F. マウス脾臓細胞を図に示した各RNAを単独または組み合わせで刺激し、IFNb1mRNAの発現を定量的RTPCR法によって解析した。U11snRNAの配列中でUの繰り返し配列を含むSM領域を元に作成した一本鎖RNA(SM-RNA)は強いIFNb1誘導能を示した(B)。またSM-RNAにS化修飾を加えることでIFNb1誘導能が増強された(SM-PS)(C)。一方で、U11snRNAにメチル化修飾を導入することで(Me-U11snRNA)、その遺伝子誘導能は著明に抑制された(D)。同様にSM-RNAの遺伝子誘導能もメチル化修飾によって著明に抑制された(SM-Me)(E)。メチル化を導入した一本鎖RNAはいずれもU11snRNAによる遺伝子誘導を著明に阻害し、特にメチル化とS化を導入した一本鎖RNA(SM-MePS)は強い阻害能を示した(F)。
**:p<0.01
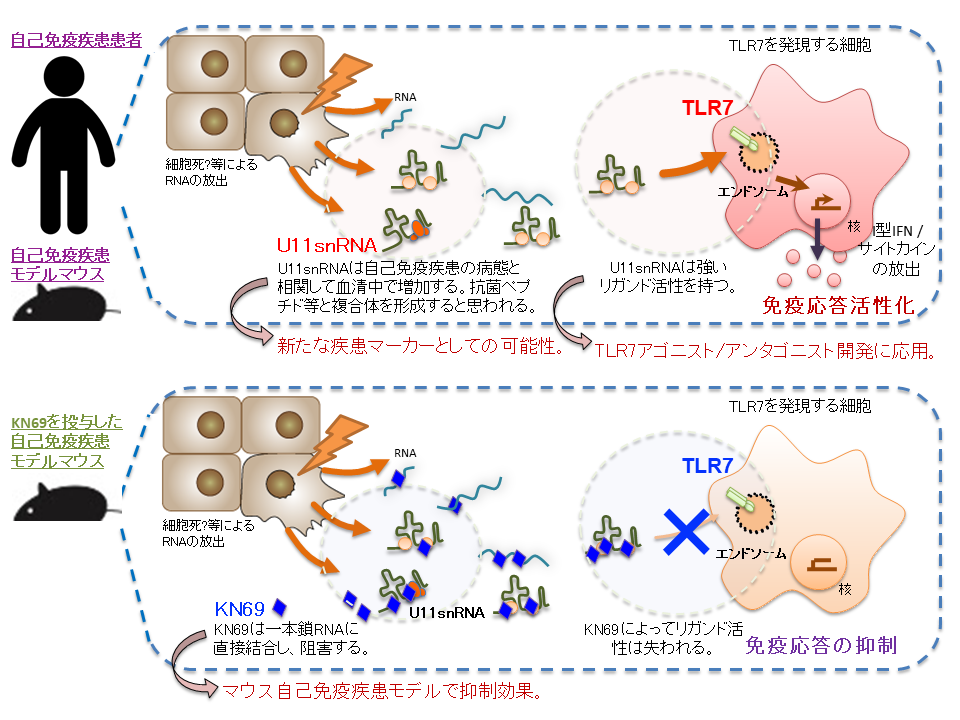
自己の細胞が何らかの傷害、ストレス等を受けることで内在する自己分子の放出が起こると考えられる。U11snRNAはその際に放出されるRNAの一つであり、自己免疫疾患の病態と相関して血清中で増加する。U11snRNAは他のRNAと比較して強いTLR7リガンド活性を有しているため、TLR7を発現するさまざまな細胞において、I型IFNや炎症性サイトカイン等を誘導することで病態の発症や増悪に寄与すると考えられる。またKN69はU11snRNAに直接結合することで、そのリガンド活性を抑制する。
これらの発見、成果は、TLR7が関与するさまざまな疾患の発症や増悪のメカニズム解明に繋がることが期待される。また、化合物やアンタゴニストは、TLR7の関与する疾患の治療薬として、アゴニストは感染症やがんに対するワクチンの効果を高めるアジュバントとしての開発がそれぞれ期待される。