CRISPR-Cas13を利用したRNA編集ツールの構造基盤を解明!
- プレスリリース
2025年4月11日
東京大学
発表のポイント
- Cas13-ADAR2融合タンパク質を利用したREPAIR法は、RNAの特定のアデノシンをイノシンへ編集可能である。
- Cas13-ADAR2-ガイドRNA-標的RNA複合体の立体構造を決定し、Cas13-ADAR2融合タンパク質によるRNA編集の分子メカニズムを解明した。
- 構造情報に基づき、高活性かつ標的組織への送達が容易な小型の「REPAIR-mini」を開発した。
- 「REPAIR-mini」は遺伝子治療への応用が期待される。
概要
CRISPR-Cas獲得免疫機構(注1)に関与するCas13タンパク質は、ガイドRNAと複合体を形成し、標的となる1本鎖RNAを切断するはたらきをもつため、RNA検出ツールやRNA編集ツールとして応用されています。近年、Cas13と脱アミノ化酵素ADAR2からなる融合タンパク質を利用したRNA編集技術であるREPAIR法が報告されました。しかし、Cas13-ADAR2が標的RNAを編集する分子メカニズムは不明でした。東京大学大学院工学系研究科化学生命工学専攻の石川潤一郎大学院生と先端科学技術研究センターの西増弘志教授らは、クライオ電子顕微鏡(注2)を用いてCas13-ADAR2-ガイドRNA-標的RNA複合体の立体構造を決定し、Cas13-ADAR2のRNA編集メカニズムを解明しました。さらに、立体構造をもとに、小型のCas13-ADAR2改変体(「REPAIR-mini」)の開発に成功しました。
本研究成果は、2025年4月11日(英国夏時間)に英国科学誌「Nature Structural & Molecular Biology」のオンライン版に掲載されました。
ゲノム編集は、従来の方法では治療が困難な遺伝子疾患を治療できる可能性を秘めています。特に、2020年にノーベル化学賞を受賞したCRISPR-Cas9を用いたゲノム編集は現在広く利用されています。しかし、Cas9を用いたゲノム編集では、「生命の設計図」であるDNAに損傷を与える可能性があるため、安全面や倫理面での課題が存在しています。一方、CRISPR-Cas13を用いたRNA編集は「遺伝情報のコピー」であるRNAを編集するため、DNAに損傷を与えることなく遺伝子疾患を治療できる可能性があります。この新たなモダリティであるRNA編集に関して、筆頭著者として論文を発表できたことを大変うれしく思います。(東京大学大学院工学系研究科 大学院生 石川潤一郎)
2020年に研究室を立ち上げてから5年が経ち、最初の学生である石川くんの研究成果が論文として発表でき、感無量です!(東京大学先端科学技術研究センター 教授 西増弘志)
発表内容
RNA編集は、ゲノムDNAを改変することなくmRNAの塩基を書き換えることによって、タンパク質のアミノ酸配列を一時的に変化させる遺伝子改変技術であり、遺伝子疾患の治療などへの応用が期待されています。2017年に報告されたRNA編集技術であるREPAIR(RNA Editing for Programmable A-to-I Replacement)法は、RNA切断活性をもたないCas13変異体とヒト由来のアデニン脱アミノ化酵素ADAR2を融合したCas13-ADAR2融合タンパク質を利用します(図1)。REPAIR法では、Cas13がガイドRNAと相補的な塩基配列をもつ標的RNAを認識すると、Cas13と融合したADAR2が標的RNA中のアデノシンを脱アミノ化し、イノシン(生体内でグアノシンとして翻訳される)に編集します。したがって、REPAIR法はグアノシンからアデノシンへの変異に起因する遺伝子疾患の治療への応用が期待されています。
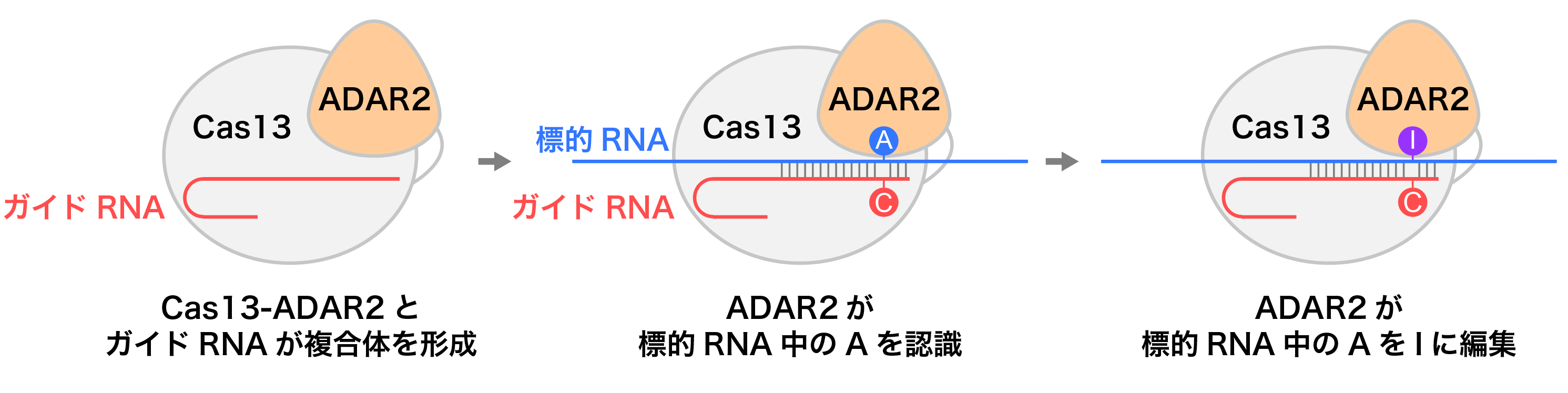
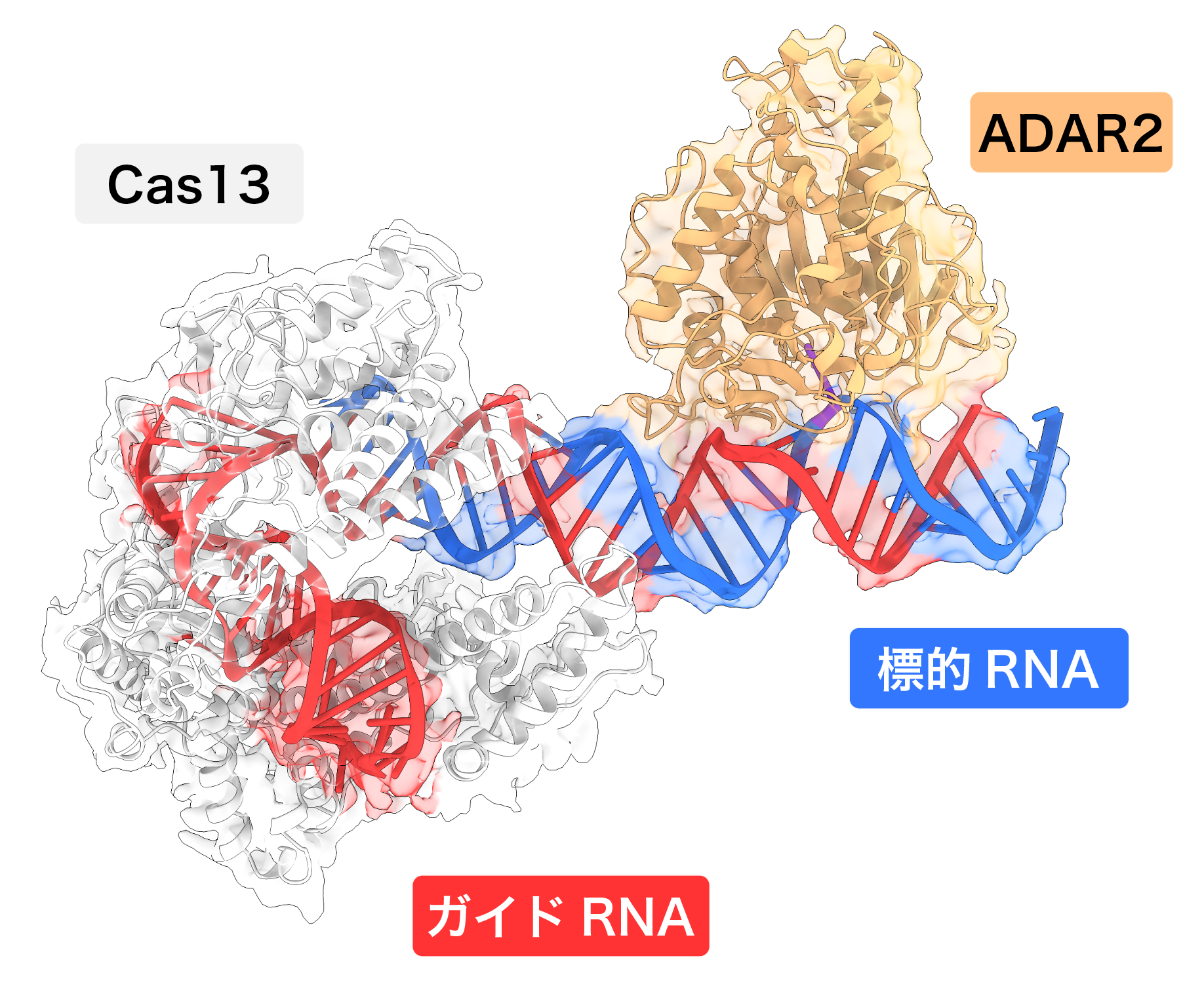
(REPAIR法) Cas13-ADAR2融合タンパク質はガイドRNAと複合体を形成した後、ガイド配列(30塩基)と相補的な標的RNAを認識する。標的RNA中の標的アデノシン(A)は、ガイドRNAのシチジン(C)とミスマッチを形成するように設計されている。標的アデノシンはADAR2によってイノシン(I)へと脱アミノ化され、イノシンは生体内でグアノシンとして翻訳される。
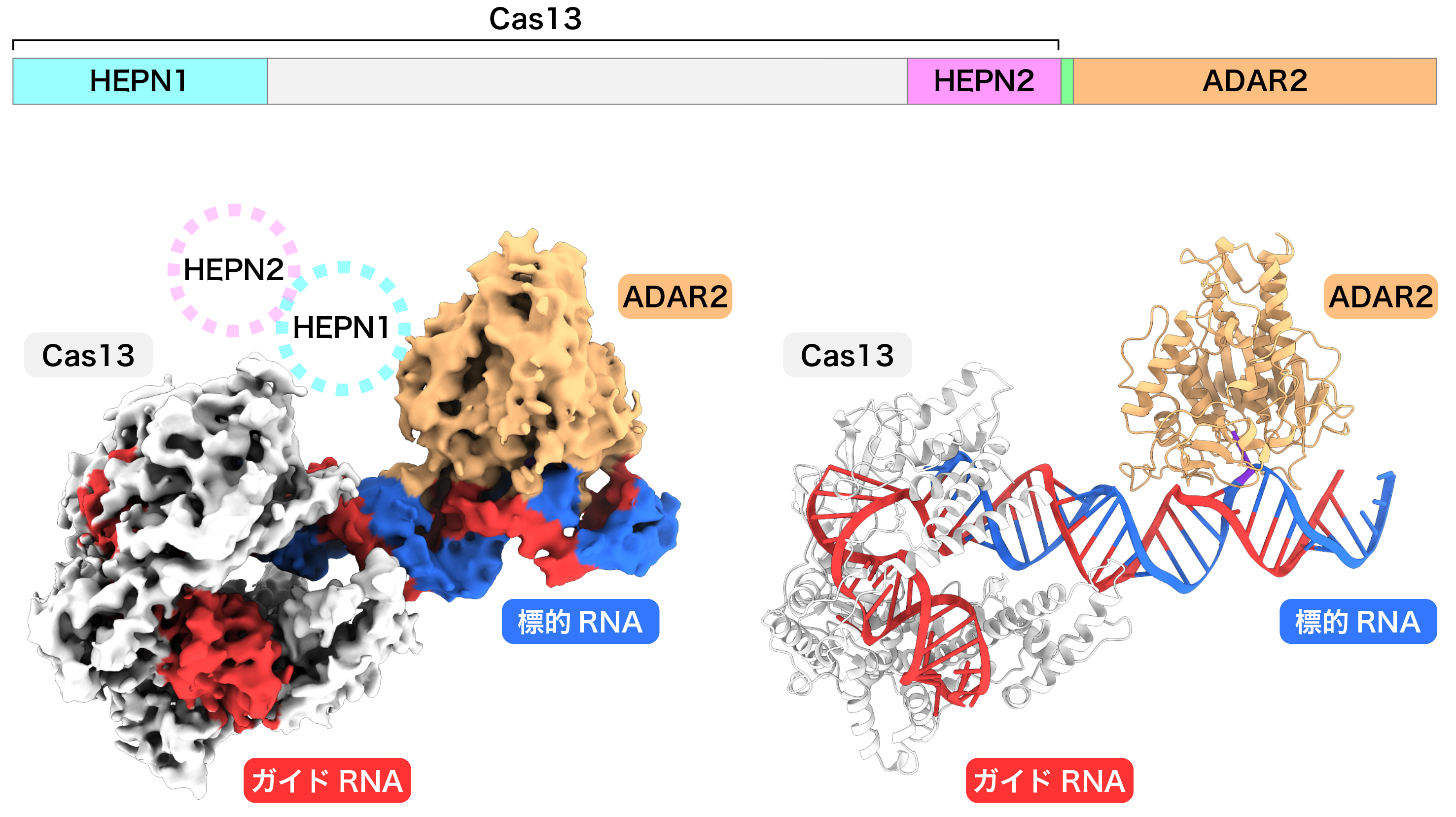
Cas13-ADAR2融合タンパク質のドメイン図(上)、REPAIR複合体の密度マップ(左)、および、REPAIR複合体の立体構造(右)を示した。Cas13はガイドRNAを認識する一方、ADAR2はガイドRNAと標的RNAからなる二本鎖領域に結合し、標的となるアデノシンを認識する。予想外なことに、Cas13のHEPNドメインの密度が観察されなかったことから、HEPNドメインはCas13-ADAR2によるRNA編集には必要ないことが示唆された。
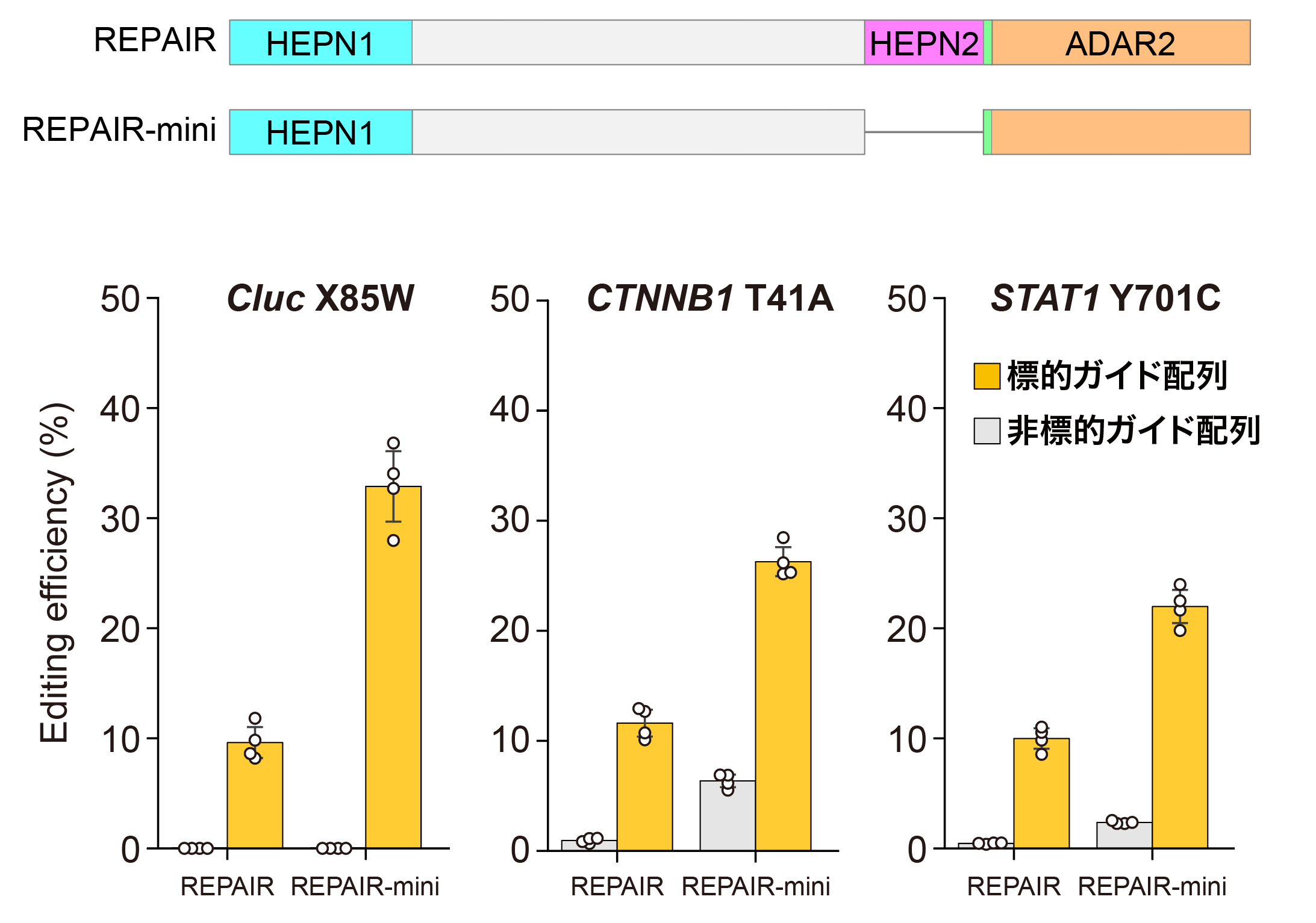
(Cluc、CTNNB1、STAT1)に対するRNA編集活性を評価した。その結果、HEPN2ドメインを削除したREPAIR-miniは通常のREPAIRよりも2~3倍高いRNA編集活性を示すことが明らかになった。標的ガイド配列および非標的ガイド配列をもつガイドRNAを用いたRNA編集活性をそれぞれ黄色と灰色の棒グラフで示した。
発表者・研究者等情報
東京大学
大学院工学系研究科
石川 潤一郎 博士課程
先端科学技術研究センター
岡崎 早恵 学術専門職員
山下 恵太郎 准教授
西増 弘志 教授
兼:東京大学大学院工学系研究科 教授
論文情報
- 雑誌名:「Nature Structural & Molecular Biology」(オンライン版:4月11日)
- 題 名:Structural insights into RNA-guided RNA editing by the Cas13b-ADAR2 complex
- 著者名:Junichiro Ishikawa, Kazuki Kato, Soumya Kannan, Sae Okazaki, Soh Ishiguro, Keitaro Yamashita, Nozomu Yachie, Tomohiro Nishizawa, Feng Zhang, Hiroshi Nishimasu*(*責任著者)
- DOI:10.1038/s41594-025-01529-1
- URL: https://doi.org/10.1038/s41594-025-01529-1
研究助成
本研究は、「特別研究員奨励費(課題番号:23KJ0720)」、国立研究開発法人日本医療研究開発機構(AMED)「創薬等先端技術支援プラットフォーム(BINDS)(課題番号:JP21am0101115)」、「ウイルス等感染症対策技術開発事業(課題番号:JP19am0401005)」、科研費「基盤研究(A)(課題番号:22H00403)」、「学術変革領域研究(A)(課題番号:21H05281)」、稲盛財団InaRISフェローシップ、武田科学振興財団「武田報彰医学研究助成」、「ライフサイエンス研究助成」、科学技術振興機構(JST)戦略的創造研究推進事業「CREST(課題番号:JPMJCR23B6)」、などの支援により実施されました。
用語解説
- (注1)CRISPR-Cas獲得免疫機構:
原核生物のもつ生体防御機構のひとつで、原核生物に感染するウイルス由来の核酸(RNAやDNA)の分解を担う。ウイルス由来核酸の分解にはCas9、Cas12、Cas13など様々なCRISPR-Cas複合体が関与する。 - (注2)クライオ電子顕微鏡:
液体窒素冷却下でタンパク質などの分子に電子線を照射し、試料の観察を行うための装置。タンパク質や核酸の立体構造の決定に利用されている。 - (注3)ドメイン:
タンパク質の機能的なひとかたまりの領域。
問合せ先
東京大学先端科学技術研究センター 構造生命科学分野
教授 西増 弘志(にします ひろし)
関連タグ

