- ホーム
- 研究について
- 研究者紹介 フロントランナー
- 014:西増 弘志 教授
014:西増 弘志 教授
西増 弘志 教授

西増 弘志 教授
構造生命科学 分野
公開日:2022年 1月 20日
多種多様なCRISPR-Casタンパク質
その立体構造を解明し、改変・活用する
タンパク質や核酸は生命の根幹となる物質だ。これらは多岐にわたる生命現象に関わり、生体機能をコントロールするうえで重要な役割を果たしている。タンパク質や核酸などの生体分子の立体構造を解析し、機能の解明に取り組むのが西増弘志教授だ。
タンパク質は、ペプチド結合したアミノ酸の鎖によって構成される。ただし、単にアミノ酸が鎖状につながっただけでは、タンパク質としての機能は発現しない。鎖状のアミノ酸が三次元的に複雑に折りたたまれ、特定の立体構造となったとき初めて、タンパク質は機能を発揮する。その立体構造の解明が、西増教授の取り組む構造生物学の中核テーマである。
なかでもCRISPR-Cas9タンパク質–核酸複合体のユニークな機能に着目し、その立体構造を決定、作動メカニズムを初めて解き明かした研究は、世界中に大きなインパクトを与えた。タンパク質や核酸を対象として生命現象を理解し、新たなテクノロジー開発までを視野に入れる西増教授の研究を紹介する。
世界最速の新型コロナウイルス検出技術を開発
ウイルスは、細胞表面にある感染受容体タンパク質から侵入してくる。新型コロナウイルス(SARS-CoV-2)の感染受容体は、ACE2タンパク質だ。このACE2にコロナウイルスのスパイクタンパク質が結合すると、ウイルスのエンベロープと呼ばれる脂質二重膜と、細胞膜との融合が始まる。そしてその融合部分から、ウイルスが細胞内へと侵入する。
「スパイクタンパク質を構成する501番目のアミノ酸が、N(アスパラギン)からY(チロシン)に置き換わるだけで、新型コロナウイルの感染力が一気に強まりました。これが変異株の正体です。N501Yはイギリスで最初に検出された変異株で、アルファ株と呼ばれています。2021年に猛威をふるったデルタ株は、L452Rの変異、つまり452番目のアミノ酸L(ロイシン)がR(アルギニン)に変わったものです。いずれもアミノ酸がわずか1個置き換わるだけで、感染力が強まったり、抗体が効きにくくなったりします。このようにタンパク質の構造から、生命現象の仕組みを解き明かすのが、構造生物学という学問分野です。構造を知ることは、その構造を標的にした薬剤の開発にもつながります」

実際に構造生物学の知見を応用して、西増教授らのチームは、新型コロナウイルスを世界最速で検出する技術の開発に成功した。2021年4月に発表した「SATORI法」は、新型コロナウイルス由来のRNAを、1分子レベルで検出することができる。しかも、検出にかかる時間はわずか5分弱だ。
「SATORI法(CRISPR-based amplification-free digital RNA detection)」は、理化学研究所の渡邉力也主任研究員が持つ世界最先端のマイクロチップ技術に、我々の専門であるCRISPR-Cas13を融合させて開発しました。この検出法では、特定のRNA配列を認識するCas13–ガイドRNA複合体と蛍光レポーターからなる混合液をバイオセンサーとして利用し、検体中のウイルスRNAの有無を検出します。検出感度が必要レベルを満たしている上に、短時間で検出でき、コストも安いのが特長です」
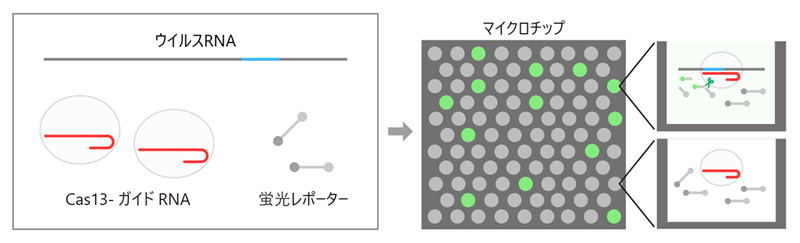
SATORI法を適用できる対象は、コロナウイルスだけに留まらない。Cas13を使って狙い定める標的RNAを変えれば、インフルエンザなど他のウイルスの検出にも応用できる。また疾患バイオマーカーの検出にも使えるため、がんなどの疾患の早期診断への応用も期待されている。
ちなみに渡邉主任研究員と西増教授は、2013年から2016年にかけて行われたJSTさきがけ「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」の同期生である。「立体構造にもとづく次世代ゲノム編集ツールの創出」というテーマで、西増教授(当時・助教)は世界を驚かせる研究成果を出している。
世界初、CRISPR-Cas9の立体構造を解明
2014年2月、西増助教(当時)らが『Cell』誌に発表した論文「Crystal structure of Cas9 in complex with guide RNA and target DNA」は、世界中の注目を集めた。この論文は今でも引用され続けていて、引用数は1600を超えている。
当時CRISPR-Cas9は、世界中の研究者が最も注目している分子のひとつだった。2012年、後にノーベル化学賞を受賞するJennifer Doudna博士が、CRISPR-Cas9の機能について報告した。これ以降、CRISPR-Cas9を巡る激しい研究競争が繰り広げられていた。
その先陣を争っていたのが、Doudna博士とFeng Zhang博士だ。Zhang博士は2013年1月3日に、CRISPR-Cas9を使ったゲノム編集に関する最初の論文を発表する。実はその4日前に、Zhang博士から濡木教授宛てに一通のメールが届いていた。Zhang博士は以前、濡木教授と共同で、あるタンパク質の構造解析を行っていた。2007年に東京大学大学院農学生命科学研究科で学位を取った西増助教は、ちょうどそのとき濡木研究室の助教として研究していた。
「Zhang博士からのメールの内容は、『共同研究でCRISPR-Cas9の構造解析をやらないか』との誘いでした。これがまさに絶妙なタイミングだったのです。そのころ農学生命科学研究科に戻る予定だったのですが、元々タンパク質-核酸複合体に興味があったので、話題のCas9タンパク質がガイドRNAと一緒にはたらくメカニズムには、すごく興味がありました。しかも世界中の研究者が先を競って研究しているテーマです。これは人生の転機と考え、濡木研究室に留まりCRISPR-Cas9の構造解析に挑戦することにしたのです」
この研究の成果は、約1年後に論文として報告された。解明したのは、Cas9–ガイドRNA複合体が標的DNAを切断する分子機構である。Cas9とガイドRNA、そして標的DNAからなる三者複合体の結晶構造を、世界で初めて解明した研究成果は、世界中の研究者が注目するところとなった。 「Cas9がガイドRNAと協働して、標的DNAを切断することは以前から分かっていました。しかし、その分子機構は謎に包まれていました。我々は試行錯誤の末に複合体の結晶化に成功し、これをSPring-8やスイスの放射光施設まで出向いてX線回折実験を行いました。その結果、結晶構造の解明にこぎつけたのです」
ガイドRNAと標的DNAが結合した複合体の構造情報は、Cas9の改良につながる基盤となる。実際にこの研究成果をベースとして、Cas9のアミノ酸残基を変え、機能を向上させる取り組みが行われている。その成果は、誤った場所を切断しにくいCas9など、複数の改良型Cas9の開発につながっている。

高速原子間力顕微鏡が捉えた、CRISPR-Cas9の動く姿
構造生物学の進歩は、研究に使える装置の進化にも大きく影響される。西増教授らがCas9–ガイドRNA–標的DNA複合体の構造解析に使ったのは、X線結晶構造解析である。解析を行うためには、まず対象となるタンパク質–核酸複合体の結晶をつくらなければならない。しかし結晶化は至難の業だった。
「結晶化の問題を解消してくれたのがクライオ電子顕微鏡です。その最大の特徴は、試料の結晶化が不要であること。ターゲットとする試料溶液が少しあれば、原子レベルの立体構造解析も可能です。この成果が高く評価され、2017年のノーベル化学賞はクライオ電子顕微鏡による立体構造解析法の開発者たちに贈られました」
西増教授もクライオ電子顕微鏡を、タンパク質の立体構造の解明に活用している。しかし、電子顕微鏡で解明できる構造は、一種のスナップ写真のようなものであり、生体中のタンパク質のダイナミックな動きを捉えることは難しい。
「タンパク質が実際に動いているところ、例えばCas9がDNAを切断する実際の動きを何とかして見ることはできないものか。そう考えたときに思い出したのが、渡邉さんと同じく『さきがけ』の同期だった、金沢大学の古寺教授でした。古寺教授が開発していた高速原子間力顕微鏡(高速AFM)を使えば、Cas9の動きを観察できるのではないかと思いついたのです」
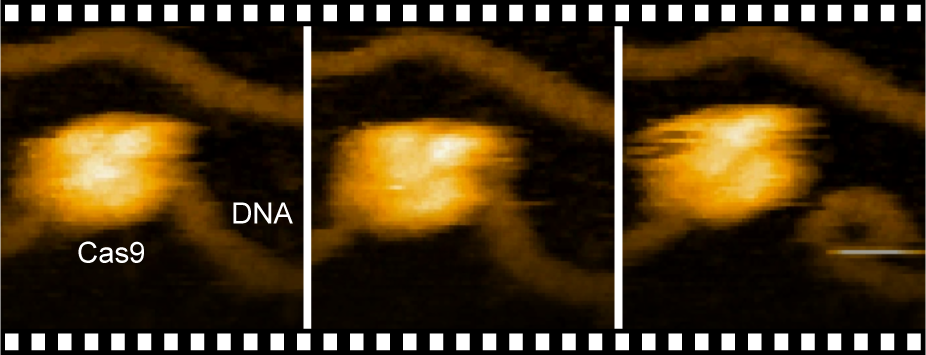
そして西増教授らは、高速AFMを使って、ナノメートル単位の空間分解能で、水溶液中の生体分子をリアルタイムに動画撮影することに成功した。
「高速AFMを使ってCas9単体を観察すると、時間とともにダイナミックに形を変える様子を捉えることができました。さらに、Cas9–ガイドRNA複合体が結晶構造と一致した安定な構造をとっている状態もカメラで押さえました。続けて、標的配列を1つだけ含むDNAとCas9–ガイドRNA複合体を混合すると、Cas9–ガイドRNA複合体はDNAと衝突を繰り返しながら、最後には標的配列を見つけて安定に結合したのです。そしてCas9がDNAを切断する瞬間を動画撮影することに成功しました」
2017年11月に発表された研究成果は『Nature Communications』に掲載された。撮影した動画を英語でTwitterに投稿したところ、一般人を含めて大きな反響があったという。
イノベーションへと導く共同研究の妙技
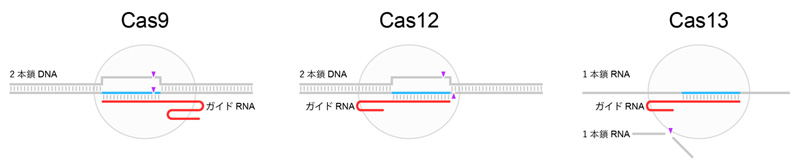
CRISPR-Casについては、Cas9のほかにもCas12やコロナウイルス検出に応用したCas13など、多様なタンパク質が見つかっている。
「Casタンパク質は、さまざまな革新技術に応用されています。Cas9とCas12は、ガイドRNAと相補的な2本鎖DNAを認識して切断する働きを持ちます。これを応用してゲノム編集や転写調節などに使われています。一方、Cas13は、ガイドRNAと相補的な1本鎖RNAを認識すると、配列非依存的に1本鎖RNAを切断する働きを持つため、RNA編集や核酸検出に応用されています」
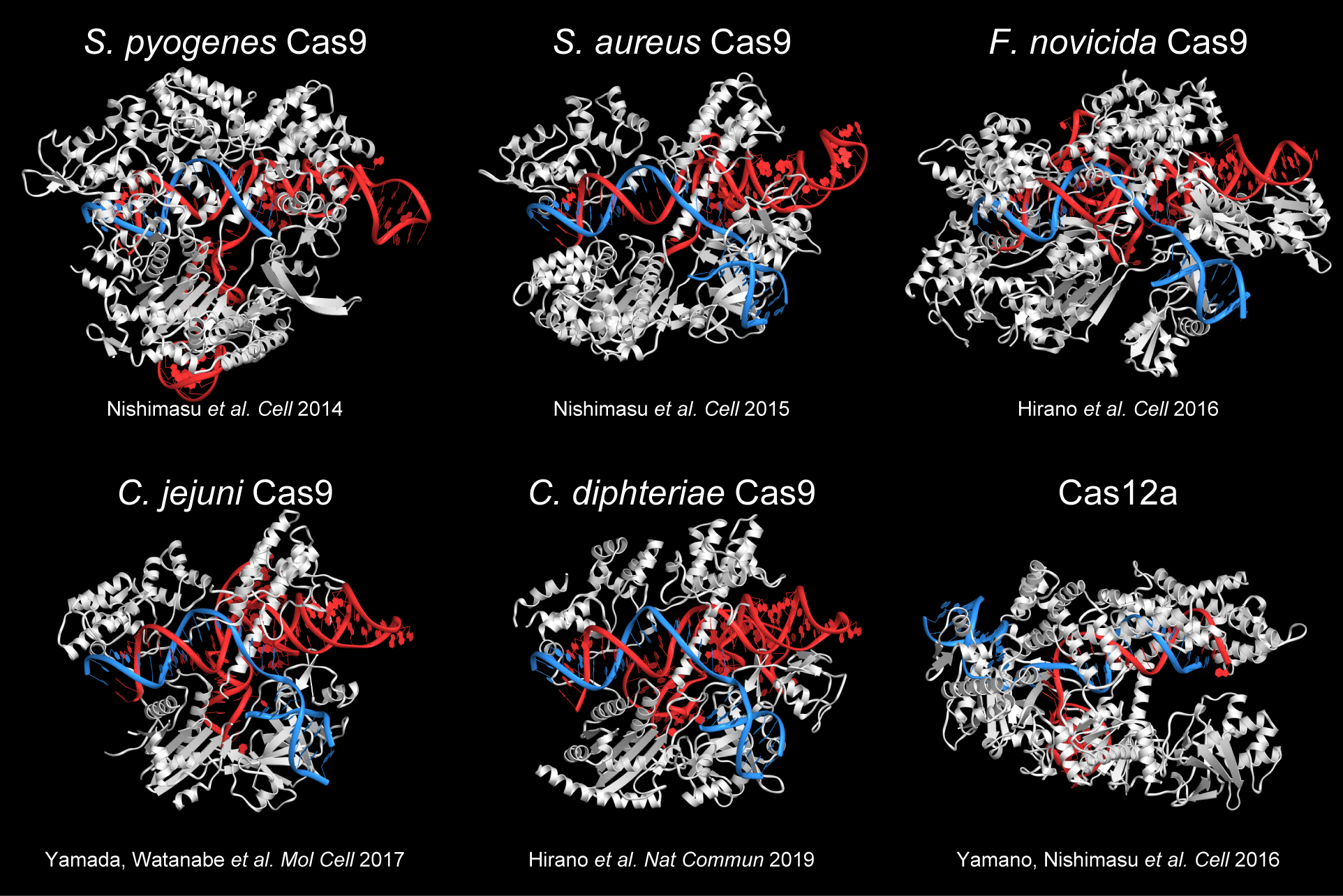
一方で、同じCRISPR-Cas9といいながらも、由来する細菌が変われば、その立体構造は異なり、作動機構も違ってくる。こうした多様なCRISPR-Cas9の解明にも教授らは取り組み、いくつもの構造解析に成功している。
また、解析した立体構造に基づき、Cas9に人為的に変異を導入した改変体の創出にも成功している。これによりゲノム編集の適用範囲が拡張され、有用なツールとして広く利用されている。
「自然界にはまだまだ多種多様なCasタンパク質が存在し、その多くは謎に包まれています。例えば海中には未知のバクテリア由来のDNAが多数存在し、そこから新しいCasタンパク質が見つかっています。その構造と機能を解明できれば、生物学全体が大きく発展する可能性があります」
西増教授は、これからの研究で成果を出すカギの一つが共同研究であり、研究相手だという。とはいえ共同で研究すれば、誰が相手でも成果が出るというほど簡単な話ではない。
「自分にはない知見や技術を持つ人、というのが大切です。自分が持っている技術と、相手の技術を組み合わせれば、世界でもまだ誰も取り組んでいない領域で成果を出せる。そんな直観がひらめくかどうかです。限られた時間を無駄にしないためには、やらないことを考えるのも重要です」
研究においてもイノベーションは、組み合わせの中から生まれる。2000年以降の構造生物学の変化を振り返れば、この領域では驚くほどの進化が起こっている。
「つい最近、GoogleがAlphaFold2というタンパク質の構造予測プログラムを公開して、私たち研究者を驚かせました。この領域での今後の変化については、仮に2021年から2030年までの10年間を予想しただけで、それこそ想像もつかないような発見が起きている可能性が高い。そんななかでも、タンパク質や核酸をきめ細かく研究し、構造解析したり機能改変したりする技術が、世界的にも私たちの強みであると分かってきました。今後は、この強みを生かしたコラボレーションにより、さらなるイノベーションを起こしていきたいと思います」
西増教授は、小学生のときにはすでに、生物に興味を抱いていたという。「同じ原子からできているのに、なぜ生物と非生物の違いが生まれるのか」。その疑問を、ずっと心の中に抱き続けてきた。西増教授は同じ疑問を胸に、これからも生命現象の神秘の解明に挑んでいく。

2007年東京大学大学院農学生命科学研究科 博士課程 修了。博士(農学)。日本学術振興会 特別研究員PD(東京大学)を経て、2007年10月より東京工業大学大学院 生命理工学研究科 特任助教。2008年より東京大学医科学研究所基礎医科学部門 助教となり、2010年、東京大学大学院理学系研究科 特任助教、2013年、東京大学大学院理学系研究科 助教、2019年、東京大学大学院理学系研究科 准教授を経て、2020年より現職。
関連タグ

