横紋筋肉腫におけるゲノム・エピゲノム異常の全体図を解明
~横紋筋肉腫を4群に分類~
- プレスリリース
2015年7月3日
1.発表者:
関 正史(東京大学大学院医学系研究科 小児科学分野 大学院生)
油谷浩幸(東京大学先端科学技術研究センター ゲノムサイエンス分野 教授)
小川誠司(京都大学大学院医学研究科 腫瘍生物学講座 教授)
2.発表のポイント:
- 筋肉や脂肪組織などから発生する小児期の腫瘍の一種、横紋筋肉腫の遺伝子異常、ゲノムの構造変化、DNAメチル化異常の全体像を明らかにしました。
- DNAメチル化のパターンから横紋筋肉腫は4群に分類されることを見出し、それぞれの群に起こりやすい遺伝子異常と病理所見および臨床的特性を明らかにしました。
- DNAメチル化異常に基づいて分類された群によって予後が異なることが明らかとなり、正確な分子診断による治療の最適化に役立つものと期待されます。
3.発表概要:
紋筋肉腫(注1)は筋肉になるもとの細胞から発生する悪性腫瘍です。筋肉、脂肪組織などから発生する小児期の腫瘍(小児軟部腫瘍)の中では最も高頻度に発生します。手術、放射線や薬物治療などを組み合わせた集学的治療により全体として約70%の治癒が期待できますが、小児では特に成長障害、臓器機能障害、不妊など、治療後に発生する障害(晩期障害)が大きな課題となっています。従って、分子病態に立脚した治療の最適化は、横紋筋肉腫の患者さんの治癒率改善と重篤な副作用や晩期障害の回避に重要といえます。
東京大学医学部附属病院小児科の滝田順子准教授、同大学院医学系研究科 小児科学分野の関正史大学院生らは同先端科学技術研究センターゲノムサイエンス分野の油谷浩幸教授、京都大学大学院医学研究科腫瘍生物学講座の小川誠司教授らと共同で、次世代シーケエンサー(注2)とアレイ技術を用いて横紋筋肉腫60例のゲノム上にみられる遺伝子異常や構造変化、エピゲノムに見られる異常の全体像を解明しました。その結果、DNAメチル化のパターンから横紋筋肉腫は4群に分類されることを見出し、それぞれの群に起こりやすい遺伝子異常と病理所見および臨床的特性を明らかにしました。
この成果は、横紋筋肉腫の予後予測、精度の高い分子診断法の開発に貢献し、治療の最適化の実現に役立つものと期待されます。
本研究は、文部科学省「次世代がん研究シーズ戦略育成プログラム」の一環として行われたものであり、その成果は2015年7月3日(英国夏時間)にNature Communicationsのオンライン版で公開されます。
4.発表内容:
①研究の背景・先行研究
横紋筋肉腫(RMS、注1)は、筋肉など軟部組織とよばれる組織に発生する小児期の腫瘍のうち最も頻度が高いものです。全体として約70%の治癒が望めますが、遠隔転移を伴う例は、集学的治療を行っても50%未満の治癒率です。また救命された例では、化学療法の副作用による不妊や、手術によって臓器の機能が損なわれてしまう臓器機能障害が重大な問題であり、現在の治療は、将来のある小児の患者さんにとって十分であるとは言えません。また、成人でも一定の割合で発生がみられ、米国の調査では30歳以上の患者が全体の約40%を占め、しかも治癒率が極端に悪いことが明らかになり、これらの成人例も含め、統一臨床試験を行う動きが始まっています。日本でも日本横紋筋肉腫研究グループ(JRSG)が中心となって2004年から小児患者で全国規模の調査が行われ、さらに患者年齢層を引き上げた新しい臨床試験を開始しようとしています。総じて、予後の悪い群に対する新規治療法の開発や、精度の高い予後予測に基づいた治療の軽減は重要な課題です。そのためには、RMSの発症や進展にはどのような分子機構が関わっているかを解明する必要があります。
RMSは組織型として胎児型(ERMS、注1)と胞巣型(ARMS、注1)に大別されます。ARMSの約70%にPAX3/7-FOXO1融合遺伝子が検出されますが、ERMSの原因となる遺伝子異常はよく分かっていませんでした。また近年、次世代シーケンサー(注2)による網羅的ゲノム解析(注3)により、RMSにおいてFGFR4経路の異常が報告されましたが、これらの異常が認められない例も多く存在し、遺伝子異常の全貌は解明されていませんでした。一方、腫瘍発生にはDNAの塩基配列異常を伴わないエピゲノム (注4) 異常も重要であると考えられていますが、RMSにおけるエピゲノム異常は、ほとんど研究されていないのが現状です。
②研究内容
そこで、東京大学医学部附属病院小児科の滝田順子准教授らは、同先端科学技術研究センター ゲノムサイエンス分野の油谷浩幸教授、京都大学大学院医学研究科腫瘍生物学講座の小川誠司教授らと共同で、網羅的ゲノム異常の検索とエピゲノム異常を同定するDNAメチル化アレイ解析(注5)を行い、RMSにおけるゲノム・エピゲノム異常の全体像を解明しました。本解析は、 RMSの大規模検体を用いた統合的ゲノム・エピゲノム解析としては世界で初めてのものになります。
本研究グループは、RMS計60例の新鮮腫瘍からDNAを採取し、まず16例について全エクソン領域を解読しました。検出された重複する腫瘍特有の変異に関して、全60例について次世代シーケンサーを用いた変異解析を行いました。また50例においてDNAメチル化アレイ解析を行いました。クラスタリング(注6)という手法を用いてDNAメチル化のパターンから4群に分類し、E1、E2、A1、A2と名付けました(図1)。さらに全例につきSNPアレイ(注7)によるゲノムコピー数の解析も行いました。得られたゲノム異常と生存期間などの臨床情報を比較することにより、4群の特徴として以下のようなことを明らかにしました。
(1) 4つの群は病理組織分類であるERMSとARMSと相関しており、ERMSが含まれる群をE1とE2、ARMSが含まれる群をA1とA2と名付けました。
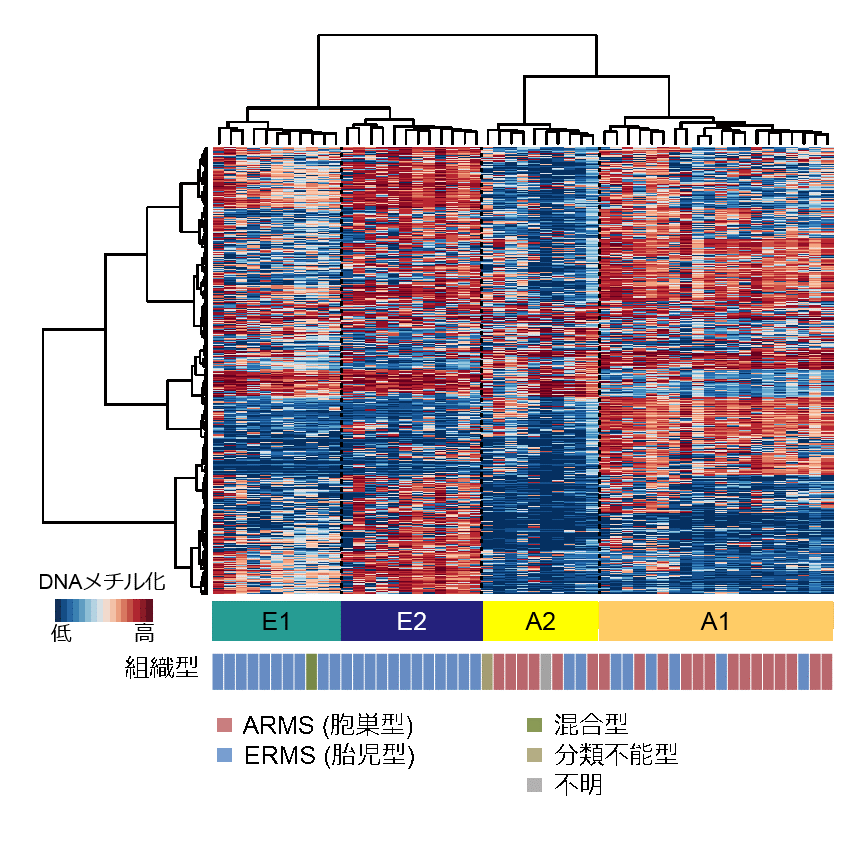
(2) E1/E2群においてFGFR4/PIK3CA経路に含まれるPTEN遺伝子の高いDNAメチル化が認められました(図2a、2b)。
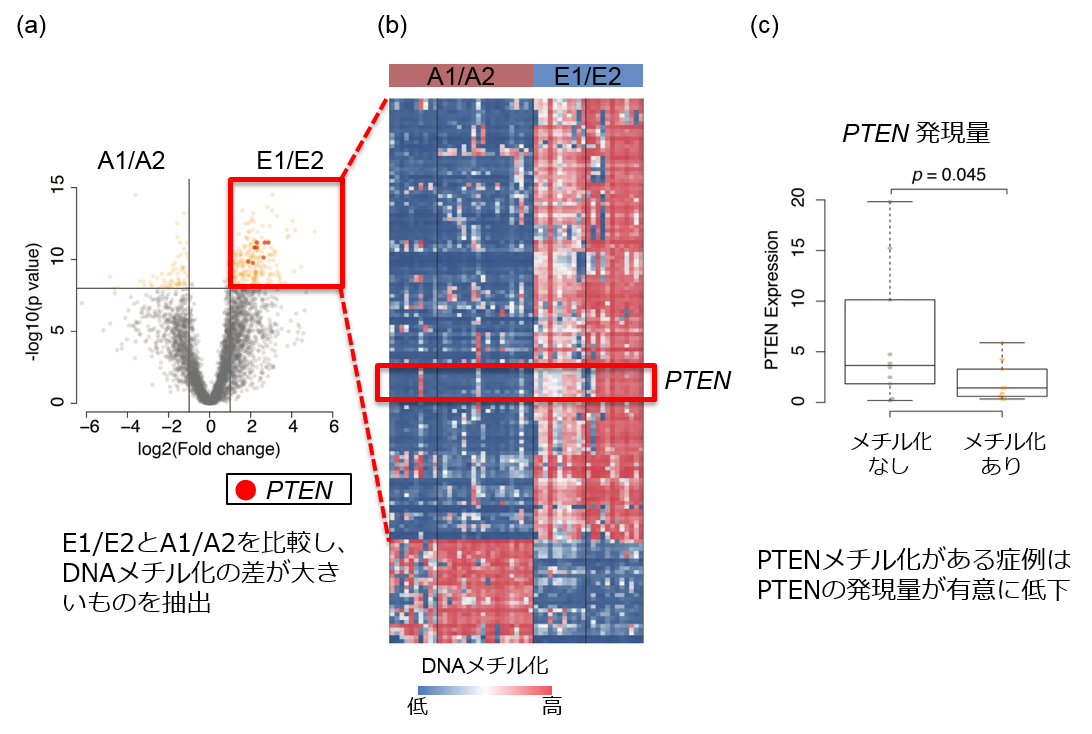
(3) FGFR4/PIK3CA経路の異常は、E2群に有意に高頻度でした。
(4) E1に比べE2は有意に予後不良であり、ARMSに比べ予後は比較的よいとされるERMSにおける予後の不良な群を抽出することができました。
E1/E2群の91%でPTENという遺伝子に高いDNAメチル化が生じていることがわかりましたが(図2a、2b)、これは同時に、これまで明らかにされていなかったERMSのエピジェネティックな特徴と言えます。一般にある遺伝子の特定の領域に高いDNAメチル化が生じると、その遺伝子の発現が抑制されますが、今回の検討でもPTEN高メチル化を認めたグループではPTENの発現低下が確認されました(図2c)。PTENはがん抑制遺伝子として機能している遺伝子であり、細胞増殖に関連するPIK3CAを抑制する機能を持ちます。そのためPTENのDNAメチル化によりPIK3CAの活性化が生じ、それがERMSの発症に関与している可能性が示唆されました。
またFGFR4/PIK3CA経路における遺伝子変異はE2群の64%にみられ、この群のみに集中していることがわかりました(図3)。がん抑制遺伝子であるTP53の変異もE2群に高頻度でした(E1群 0%、E2群 46%)。さらに生存期間との検討を行うと、興味深いことにE1群の予後は極めて良好で死亡例は認められなかったのに対して、E2群の予後は不良で有意に生存期間の短縮が認められました(図4)。これまで一つの群として捉えられていたERMSをDNAメチル化のパターンにより予後の異なる2群に分類し、遺伝子異常の特性を明らかにしたことは、治療を行う上でも非常に有用です。予後の悪いE2群ではFGFR4/ PIK3CA阻害剤を用いた新たな治療戦略の可能性が示され、また予後が極めて良好なE1群に対しては治療軽減の試みの足がかりが示されました。
③社会的意義・今後の予定
本研究によってRMSのゲノム・エピゲノムの全体像が明らかとなり、RMSの分子病態の理解に大きな進展をもたらしました。DNAメチル化のパターンの違いによりRMSは4群に分類されることが判明しましたが、これはDNAメチル化情報がRMSにおける新たな予後予測のバイオマーカーとなりうることを示したもので、新規分子診断法の提唱という観点から重要な発見と言えます。この新たな分子診断は、患者さんの個々の治療を考える上で重要であり、臨床的にもインパクトの大きい知見といえます。精度の高い新規分子診断はRMSの治療の最適化に貢献し、予後を改善するのみならずQOLの向上にもつながるものと期待されます。今後はさらに治療背景の異なる大規模かつ独立したコホートに対して、検証を行う予定です。
本研究は、東京大学医学部附属病院小児科の滝田順子准教授、京都大学大学院医学研究科腫瘍生物学講座の小川誠司教授、東京大学先端科学技術研究センターゲノムサイエンス分野の油谷浩幸教授、群馬県立小児医療センターの林泰秀前病院長、京都府立医科大学小児科の細井創教授、埼玉県立小児医療センターの花田良二副院長、神奈川県立こども医療センター臨床研究所病理診断科の田中祐吉部長、東京大学医科学研究所附属ヒトゲノム解析センターの宮野悟教授らの共同研究チームによって行われました。
5.発表雑誌:
論文タイトル: Integrated genetic and epigenetic analysis defines novel molecular subgroups in rhabdomyosarcoma
著者: Masafumi Seki*, Riki Nishimura, Kenichi Yoshida, Teppei Shimamura, Yuichi Shiraishi, Yusuke Sato, Motohiro Kato, Kenichi Chiba, Hiroko Tanaka, Noriko Hoshino, Genta Nagae, Yusuke Shiozawa, Yusuke Okuno, Hajime Hosoi, Yukichi Tanaka, Hajime Okita, Mitsuru Miyachi, Ryota Souzaki, Tomoaki Taguchi, Katsuyoshi Koh, Ryoji Hanada, Keisuke Kato, Yuko Nomura, Masaharu Akiyama, Akira Oka, Takashi Igarashi, Satoru Miyano, Hiroyuki Aburatani, Yasuhide Hayashi, Seishi Ogawa*, Junko Takita*
DOI番号:10.1038/ncomms8557
URL:http://www.nature.com/ncomms/index.html
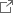
6.問い合わせ先:
東京大学医学部附属病院 小児科
准教授 滝田順子(たきた じゅんこ)
東京大学先端科学技術研究センター ゲノムサイエンス分野
教授 油谷浩幸(あぶらたに ひろゆき)
京都大学大学院医学研究科 腫瘍生物学講座
教授 小川誠司(おがわ せいし)
《 取材に関するお問い合わせ 》
東京大学医学部附属病院 パブリック・リレーションセンター (担当:渡部、小岩井)
東京大学先端科学技術研究センター 広報・情報室 (担当:村山)
京都大学 企画・情報部広報課 広報企画掛 (担当:進藤)
7.用語解説:
注1:横紋筋肉腫 (RMS)
体を動かすときに使う筋肉を骨格筋といい、骨格筋は横紋筋という種類の筋肉で形成される。横紋筋肉腫は、骨格筋の未熟な細胞から発生した悪性腫瘍であると考えられている。皮膚、消化管などの体の表面や内臓を形成している組織にできる悪性腫瘍のことを「がん」といい、上皮組織以外の骨や、筋肉や脂肪などの軟らかい組織(軟部組織)にできる悪性腫瘍のことを「肉腫」とよぶ。横紋筋肉腫は、骨格筋以外にも膀胱や鼻、眼の奥、肛門などから発生することも少なくない。顕微鏡で観察した組織の病理所見により、主に胎児型(ERMS)と胞巣型(ARMS)の2つに分けられる。
注2: 次世代シーケンサー
大量同時並列シーケンサーとも呼ばれ、従来の手法と比較し極めて高速にDNAの塩基配列を読むことが可能となり、スーパーコンピューターを用いれば、ヒト全ゲノムの解析もわずか1週間以内で解読が可能となった。
注3:ゲノム
ある生物のもつすべての遺伝情報、あるいはこれを保持するDNAの全塩基配列のこと。タンパク質のアミノ酸配列をコードするコーディング(エクソン)領域とそれ以外のノンコーディング領域に大別される。
注4:エピゲノム
エピゲノムという細胞の形質を娘細胞に伝達する仕組みのうち、DNAの塩基配列以外の要素のことを指す。遺伝子発現の制御に重要な役割を果たし、発生・細胞の分化、発がんにおいても重要なメカニズムと考えられている。DNAのメチル化や脱メチル化による遺伝子発現の制御が代表的な機構。
注5:DNAメチル化アレイ
エピゲノムの代表的な変化であるDNAメチル化を網羅的に解析することができるマイクロアレイとよばれる微小なチップ。現在最大で、一度にゲノム上の45万か所についてDNAメチル化の有無について評価が可能である。
注6:クラスタリング
複数サンプルを大きくいくつの群に分かれるのか推定することができる手法。複数のサンプルのうち、一番傾向が似ている2つのサンプルを横に並べていく。さらに2つのサンプルの結果を平均化し、同様に傾向が似ているサンプルを横に並べていくと、トーナメント表のような樹形図を書くことができる。
注7:SNPアレイ
SNPとは一塩基多型(Single Nucleotide Polymorphism)の略。個人によって異なるヒトゲノムの配列は多型と呼ばれ、SNPはヒトゲノムの多型の中で最も普通に認められる多型。SNPを解析することにより、腫瘍に生じているゲノムのコピー数を解析することができる。正常のゲノムでは、どの遺伝子も通常2コピーだが、がんのゲノムでは、しばしばコピー数に変化が生じる。
8.添付資料:
DNAメチル化アレイの結果から、RMSを4つの群に分類しています。この4つの群をE1、E2、A1、A2と名付けました。横にRMSの検体、縦にDNAメチル化を調べた遺伝子の部位が示されています。赤で示したものが高メチル化、青で示したものが低メチル化を示している部位になります。大きく2つに分けると、E1/E2、A1/A2の2つになり、E1/E2は胎児型(ERMS)、A1/A2は胞巣型(ARMS)にほぼ一致した分類となっていました。
(a)のグラフでは左上、右上の領域にある点ほど、DNAメチル化の差が大きいものになり、右上の領域がE1/E2のグループで高いDNAメチル化が認められる点になります。E1/E2、A1/A2のDNAメチル化の違いを比較すると、極めてDNAメチル化の程度が異なっていた部位(オレンジ)として、PTENという遺伝子が抽出されました。(a)の赤枠で囲われたオレンジの部位を、高いDNAメチル化を赤、低いDNAメチル化を青で示した図で示すと、(b)のようになりE1/E2群においてA1/A2と比べ明らかにPTENの高いDNAメチル化が生じていることがわかります。DNAメチル化は遺伝子発現を低下させるため、PTENの発現量をDNAメチル化の有無で比較したところ、有意にPTENの発現は低いことが確認されました(c)。
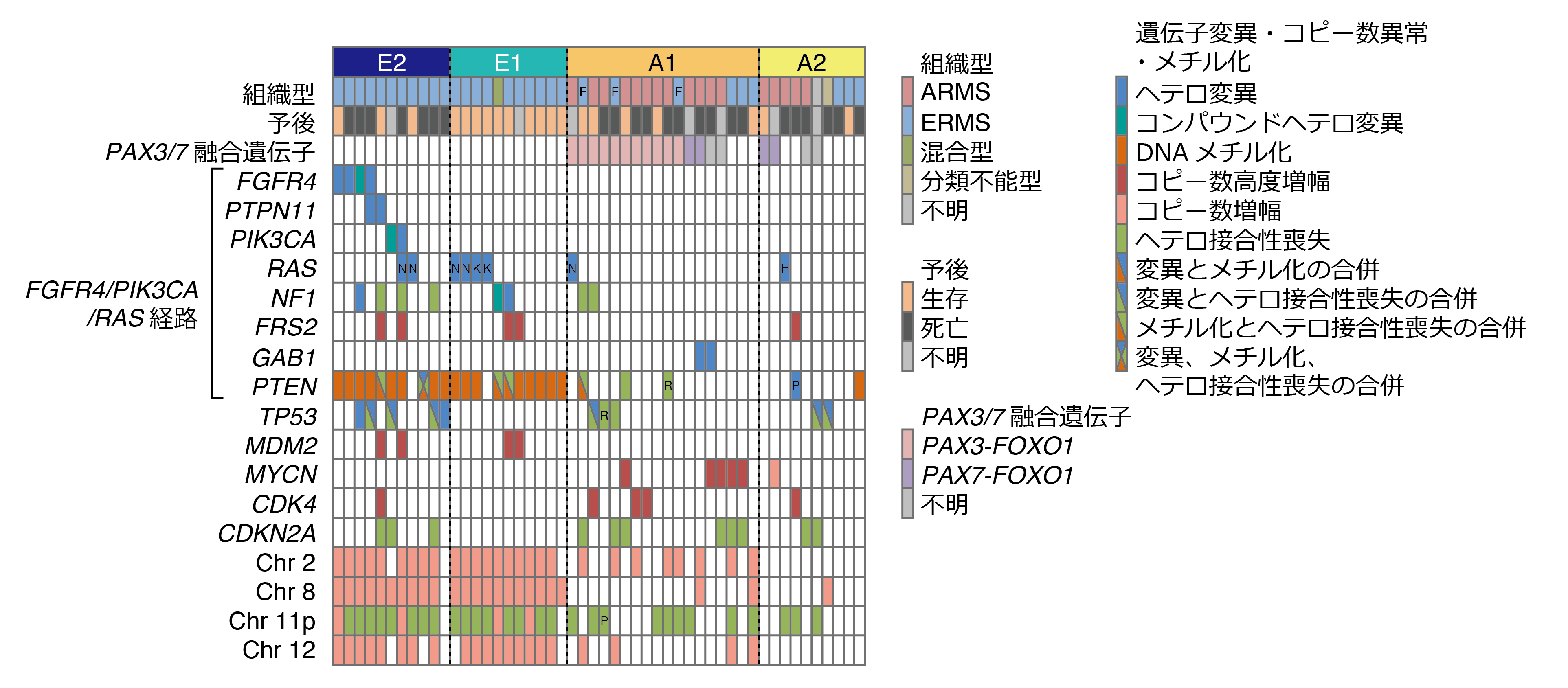
DNA異常メチル化によるグループに基づき、遺伝子異常やコピー数異常との関連を示しています。E1/E2ではPTENにおいてオレンジで示されているようにほとんどの検体で高いDNAメチル化が認められますが、A1/A2ではほぼ認められません。また、FGFR4、PTPN11、PIK3CAといったFGFR4経路に含まれる遺伝子異常は特にE2に多いことがわかります。またがん抑制遺伝子としてよく知られているTP53もE2において異常が集中して認められます。
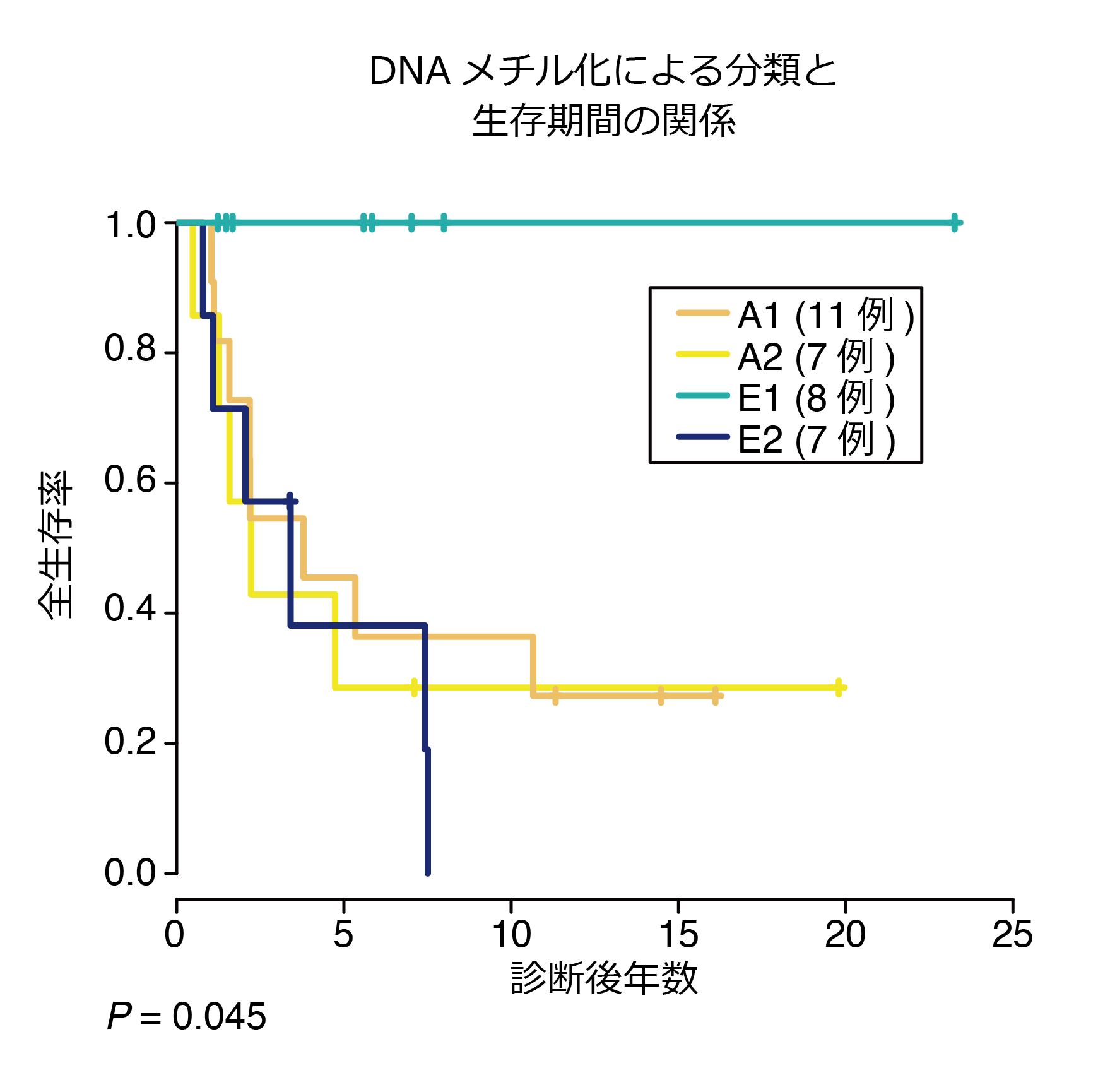
生存期間について解析すると明らかにE1に比べE2において死亡例が多く、E1は解析可能であった8例において、死亡例はないという結果でした。このことにより、これまでは組織型により1つであったERMSをDNAメチル化のグループにより2つに分類することができ、かつそのグループが予後と強い相関を示していることがわかりました。
関連タグ

