脂肪燃焼体質を作るには、寒さの感知とエピゲノムの変化が重要
エピゲノム(遺伝子の後天的修飾)を介した寒冷環境への適応機構の解明
- プレスリリース
2018年4月19日
1.発表者:
酒井 寿郎
(東京大学先端科学技術研究センター 代謝医学分野 教授 /東北大学大学院医学系研究科 分子生理学分野 教授)
2.発表のポイント:
3.発表概要:
恒温動物は寒冷環境に適応するしくみを持っていますが、この際に重要な役割を持つのが脂肪細胞です。急激に環境の温度が低下すると交感神経系が活性化し、褐色脂肪細胞(注3)で脂肪が燃焼され、熱が産生されます。一般によく知られている白色脂肪組織は、エネルギーを脂肪として貯めることが主たる役割であるため熱産生能を有しておらず、熱産生に関与する遺伝子(注4)も発現していません。しかし、寒冷環境が長期に持続すると、白色脂肪組織でも、脂肪燃焼と熱産生に関わる遺伝子が誘導され、寒冷環境に個体が耐えられるよう適応します。
本来、細胞には「エピゲノム」というゲノムの後天的な調節機構が備わっており、エピゲノムのしくみにより細胞の種類ごとに働く遺伝子(活動中)と働かない遺伝子(休止中)が明確に決められています。脂肪を貯める機能を担う白色脂肪細胞では、通常は脂肪燃焼や熱産生に関わる遺伝子は「休止中」で、働くことができません。では、恒温動物が長期の寒冷刺激を受けると、どのようにして遺伝子に寒冷環境に適応した体質への変化を促すのでしょうか?
東京大学先端科学技術研究センター/東北大学 大学院医学系研究科の酒井寿郎 教授、群馬大学生体調節研究所の稲垣 毅 教授、学術振興会特別研究員の阿部陽平、東京大学大学院薬学系研究科大学院生の藤原庸右および東京大学大学院医学系研究科大学院生の高橋宙大らの研究グループは、遺伝子がエピゲノムによって通常は「休止中」となっている白色脂肪組織に着目し、慢性の寒冷刺激による脂肪組織のベージュ化過程におけるエピゲノム解析を行いました。寒冷刺激を受けるとアドレナリン作用によってヒストン脱メチル化酵素JMJD1A(注5)がリン酸化され、寒冷刺激が持続すると必要な機能を獲得したJMJD1A がエピゲノム変化を介して「休止中」だった脂肪燃焼と熱産生に関わる遺伝子群を「活動中」にし、遺伝子を発現させて、ベージュ化を誘導し、寒冷環境に慢性的に適応するしくみがあることがわかりました(図)。本成果は、肥満や生活習慣病に対する新規治療法の開発に応用できるものと期待されます。
本研究は、文部科学省 科学研究費 基盤研究(S)「環境因子とエピゲノム記憶による生活習慣病発症の解明」、新学術領域研究「温度生物学」、文部科学省の産学連携プログラムである先端融合領域イノベーション創出拠点の形成プログラム「システム疾患生命科学による先端医療技術開発」等の支援のもとで行われたものです。本研究成果は国際科学誌 Nature Communications に2018年4月19日付オンライン版で発表されました。
4.発表内容:
<研究の背景>
寒さは命に関わる低体温症を引き起こすおそれのある危険な環境です。恒温動物は寒さに応答し、適応するために、脂肪を燃焼し熱を産生するシステムを持っています。私たちの身体には、皮下の白色脂肪組織に存在し、エネルギーを脂肪として貯める白色脂肪細胞と、褐色脂肪組織に存在し、脂肪を燃焼し熱を産生する褐色脂肪細胞があります。白色脂肪細胞も褐色脂肪細胞も生まれながらに備わっています。恒常的に存在する褐色脂肪細胞は、個体への寒冷刺激にともなって短時間で急激に脂肪燃焼や熱産生に関わる遺伝子の発現を増加させ、熱産生の容量を最大限に増大させます(図上)。これに加えて、「ベージュ脂肪細胞」とよばれる第二の熱産生脂肪細胞の存在が近年明らかにされています。褐色脂肪細胞が特に新生児に多く存在するのに比べ、ベージュ脂肪細胞は寒さに適応していくために新たにつくられる「誘導型」の熱産生脂肪細胞です。
後天的なゲノム修飾であるエピゲノムは、ゲノムの遺伝情報のうち、実際に働く領域(活動中)と働かない領域(休止中)を決定し、細胞の記憶として機能します。褐色脂肪細胞では、脂肪燃焼や熱産生に関わる遺伝子はエピゲノムの働きによって「活動中」のクロマチン構造(注6)をとっています。一方で、脂肪を貯めることが主たる役割である白色脂肪組織では、脂肪燃焼や熱産生に関わる遺伝子は「休止中」のクロマチン構造をとっているため、寒さの刺激ですぐに脂肪燃焼や熱産生に関わる遺伝子の発現が誘導されることはありません。
<研究の内容>
研究グループは、先行研究で短期の寒冷刺激に伴いJMJD1A の 265 番目のセリン残基がリン酸化され、急性期の熱産生に必要な機能を獲得することを見出しました(Nature Communications 2015)。今回、265 番目のセリン残基をリン酸化されないアラニン残基に置換した変異型 JMJD1A をもつマウスを作製し、寒さに対する適応を解析しました。急激な寒冷刺激下では、変異体マウスは寒冷を感知できないため、通常のマウスと比べて顕著に体温が低下しました。また長期(一週間)の寒冷刺激下では、変異体マウスは寒冷刺激をエピゲノムに伝えることができないため、野生型マウスと比較して、脂肪燃焼、熱産生、そして白色脂肪組織のベージュ化が顕著に抑制され、寒冷への適応力が低下していることが明らかになりました。
ベージュ脂肪細胞は、熱産生のために糖や脂肪を活発に消費します。白色脂肪組織のベージュ化が抑制されている変異体マウスは、高栄養の食事を与えると野生型(通常の)マウスと比べ、インスリンのはたらきが悪く、高インスリン血症を呈しました。この研究の結果は、インスリンのはたらきが悪くなる2型糖尿病の治療法に応用できると考えています。
今回の研究から、寒冷環境への適応のしくみについて、(1)恒温動物が寒さに直面すると、褐色脂肪組織のJMJD1Aが寒さを感知することで急速な熱産生を行い、(2)寒さが長期に持続すると白色脂肪組織のJMJD1Aが寒さをエピゲノムに伝え、脂肪を燃焼し熱を産生する「誘導型」のベージュ脂肪細胞を新たにつくる、ということがわかりました。また、白色脂肪組織のベージュ化では、寒さの感知によるJMJD1Aのリン酸化(第一段階)、ヒストン脱メチル化によるエピゲノムの変化(第二段階)、という機構を介して、「休止中」の脂肪燃焼と熱産生に関わる遺伝子を「活動中」にし、慢性的な寒さに適応することが初めて明らかとなりました。
<社会的意義>
ベージュ脂肪細胞は、熱産生のために糖や脂肪を活発に消費することから、近年、栄養過多に伴う2型糖尿病などの生活習慣病の治療標的として注目されています。JMJD1A のリン酸化を標的とした脂肪組織のベージュ化機構にもとづく生活習慣病の治療・予防法の開発に応用できるものと期待されます。
5.発表雑誌:
- 雑誌名:
- Nature Communications Online Edition
- 論文タイトル:
- Histone demethylase JMJD1A coordinates acute and chronic adaptation to cold stress via thermogenic phospho-switch
- 著者:
- Yohei Abe, Yosuke Fujiwara, Hiroki Takahashi, Yoshihiro Matsumura, Tomonobu Sawada, Shuying Jiang, Ryo Nakaki, Aoi Uchida, Noriko Nagao, Makoto Naito, Shingo Kajimura, Hiroshi Kimura, Timothy F. Osborne, Hiroyuki Aburatani, Tatsuhiko Kodama, Takeshi Inagaki*, Juro Sakai*(* 責任著者)
6.問い合わせ先:
<研究内容に関するお問い合わせ先>
東京大学先端科学技術研究センター 代謝医学分野
東北大学 大学院 医学系研究科 細胞生物学講座 分子生理学分野
教授 酒井 寿郎(さかい じゅろう)
<広報担当者連絡先>
東京大学先端科学技術研究センター
広報・情報室(担当 村山)
東北大学 大学院医学系研究科・医学部 広報室
7.用語解説:
(注1)ベージュ脂肪細胞:長期寒冷刺激などによって、脂肪を蓄積する白色脂肪(前駆)細胞において、通常は発現しない熱産生遺伝子が認められる。このような褐色脂肪細胞様に変化した細胞をベージュ脂肪細胞と呼び、その過程をベージュ化という。ベージュ脂肪細胞は脂肪燃焼(熱産生)を誘導することができるため、このメカニズムの解明は抗肥満の観点から着目されている。
(注2)エピゲノム:ゲノムは生命の設計図である。すべてのゲノム遺伝情報のうち、実際に働く領域(活動中)と働かない領域(休止中)、すなわち RNA として転写される領域と転写されない領域があり、これらは後天的にゲノムにほどこされる化学修飾によって決められている。この後天的なゲノムへの化学修飾を「エピゲノム」という。環境の変化に個体が適応するために、エピゲノムは環境によって多様に変化し、遺伝子の発現を調節し、細胞の形質を変化させる。我々がさまざまな環境の変化に適応できるのはエピゲノムのおかげである。
(注3)褐色脂肪細胞:一般的によく知られている白色脂肪細胞は脂肪の蓄積を行うのに対し、褐色脂肪細胞は体を震わせないでからだの熱を産生することが可能である。
(注4)熱産生に関与する遺伝子:交感神経から分泌されるノルアドレナリンなどの受容体である β アドレナリン受容体(Adrb1)や、ミトコンドリアにある脱共役タンパク質(Ucp1)など、熱を産生するために必要な鍵となるタンパク質群をコードする遺伝子群を示す。
(注5)JMJD1A:ヒストン脱メチル化酵素の一つで、エネルギー消費、性決定、腫瘍形成、低酸素による応答など、環境変化に多様に応答して機能する。
(注6)クロマチン:ゲノム DNA はヒストンに巻き付いて存在する。クロマチンとはこのヌクレオソームと呼ばれる最小単位は繊維状につながった構造体。クロマチンは何重にも巻いた複雑な構造をとってクロモソーム(染色体)として核内にとして収まっている。クロマチン繊維が構造的にほどけている領域は遺伝子が活発にはたらく領域(活動中)で、凝集している領域は遺伝子がはたらかない領域(休止中)となる。クロマチンの一部にメチル化酵素によって「休止中を示すメチル化標識」がつけられると、凝集したクロマチン繊維となり遺伝子がはたらかない領域になる。一方、この「休止中を示すメチル化標識」が脱メチル化酵素によってはずされますと、ほどけたクロマチン繊維となり、遺伝子が活発にはたらく領域となる。
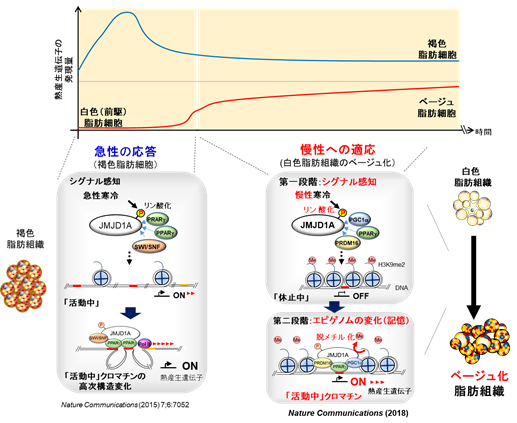
個体が急激に寒さに暴露されると、褐色脂肪細胞で熱産生遺伝子の発現が急上昇し、熱産生容量が急速に増加する(図上、グラフ中青線)。この寒さが慢性的に持続すると、白色脂肪組織に熱産生遺伝子が発現し、熱産生能を獲得し、慢性的な寒さに適応する(図上 グラフ中赤線)。
急性の寒冷刺激では、褐色脂肪組織の JMJD1A がリン酸化され、「ほどけたクロマチン構造」を持つ「活動中」の状態にある熱産生遺伝子の高次構造を変化させ、転写を 急速に誘導する(左下図)。一方で、本研究では、「凝集」した「休止中」の状態にある皮下白色脂肪組織の熱産生遺伝子が JMJD1A のリン酸化とヒストン脱メチル化活性によって「休止中」のヘテロクロマチンから、「活動中」のほどけた構造をもつユークロマチンへと変化し、これによって白色脂肪組織がベージュ脂肪細胞へと形質が変えることで、個体が慢性的な寒冷環境に適応する(右下図)。
関連タグ