分子を大きくして渋滞解消: 3億個の分子を動かしてセルロースの酵素分解メカニズムを解明
- プレスリリース
2019年3月4日
1.発表者:
- 江 崎 貴 裕
- (東京大学先端科学技術研究センター 客員研究員 / JSTさきがけ研究員)
- 西 成 活 裕
- (東京大学先端科学技術研究センター 教授)
- 鮫 島 正 浩
- (東京大学大学院農学生命科学研究科 教授)
- 五十嵐 圭日子
- (東京大学大学院農学生命科学研究科 准教授 / VTTフィンランド技術研究センター 客員教授)
2.発表のポイント:
◆セルラーゼの動きをシミュレートするミクロモデルを構築し、その集団的な振る舞いを分析することでセルロースの分解速度が低下するメカニズムを明らかにしました。
◆セルラーゼ分子内の各ドメインの大きさが重要な要因であり、これを変化させることで「渋滞」を解消し、反応を効率化できることを初めて発見しました。
◆本研究成果は、将来のセルロース系バイオマス利用の効率化に大きく貢献することが期待されます。
3.発表概要:
植物細胞壁の主成分であるセルロースは、分解するとぶどう糖(グルコース)を生成するため、バイオエタノールやバイオ化成品などの原料としての利用が注目されています。環境に負荷をかけない有力な分解方法の一つとしてセルロース分解酵素(セルラーゼ)を用いる方法が知られていますが、この酵素による反応は極めて遅く、しかもその理由は未解明でした。特に、分子一つ一つの動きに注目したこれまでの研究においても、その反応性の低さを十分に説明することができておらず、集団的な何らかの現象がこの反応を支配していることが示唆されていました。東京大学大学院農学生命科学研究科の五十嵐圭日子准教授(VTTフィンランド技術研究センター客員教授)と先端科学技術研究センターの江崎貴裕客員研究員(JSTさきがけ研究員)らの研究グループは、一分子計測の結果からセルラーゼの動きを再現するモデルを構築し、無数の酵素の動きをシミュレートすることによって、現在得られている生化学実験の結果をさまざまな角度から再現することを試みました。さらにこのモデルを分析することによって、セルラーゼの分子サイズが反応の速さを支配的に決めていることを発見しました。この研究成果は、既存の一分子に着目したミクロな視点の研究でも生化学反応的特性に着目したマクロな視点の研究でもない全く異なる知見を提供し、今後の効率的なバイオマス変換に大きく貢献するものと考えられます。本研究成果は物理学分野で権威の高いPhysical Review Lettersに掲載されます(オンライン版:3月6日公開予定)。
4.発表内容:
植物の細胞壁や植物繊維の主な成分はセルロースと呼ばれる多糖類の一つで、地球上で最も多く存在する有機物です。これを分解して得られるグルコースからは、バイオ燃料やバイオプラスチックを生産することができるため、再生可能な生物資源(バイオマス)としての利用が期待されています。しかし、セルロースは極めて安定な化合物であるため、その分解には一般的に膨大なエネルギーが必要となります。一方、自然界では、微生物由来のセルロース分解酵素(セルラーゼ)によってセルロースが常温常圧の条件で分解されています。バイオマス利用の低コスト化のためにこのセルラーゼを活用する分解方法が注目されています。
セルラーゼを利用したセルロース分解において障害となっているのが、その反応の遅さです。この酵素が固体表面で機能する酵素であるという特殊な性質から、単にこの酵素を大量に投入しても反応速度を上げることができないことが実験的に知られています。しかしながら、そのような現象がなぜ起こるのか、またそれを解消することはできるのかについては明らかになっていませんでした。
近年の一分子観察の結果から、セルラーゼ分子の動きがより詳細に理解されるようになり、個々の分子の反応速度は生化学実験から見積もられる速度よりも数百倍速いということが分かってきました。つまり、反応速度が遅いのは分子の動きが遅いからではないということを示しており、このミクロな一分子測定とマクロな生化学実験結果の間の大きなギャップが、長年研究者たちを悩ませてきました。本研究グループの先行研究では、高速原子間力顕微鏡による測定によって、セルラーゼ分子を車、セルロース表面を道路とした時に酵素が「交通渋滞」することなどが示されていました。この結果はセルラーゼ分子同士の体積的な相互作用が反応に関係していることを強く示唆していますが、数百倍の差を説明するためには単なる渋滞だけでない、反応をより強力に抑制する何らかのメカニズムが存在するはずであると考えられました。
本研究グループは一分子計測の既存研究で報告されているセルラーゼ分子一つ一つの動きを記述するレート(単位時間当たりに何回その状態遷移が起こるか)を忠実に組み込んだモデルを構築しました。そしてこのモデルに基づいて、既存研究の生化学実験の条件と同じ設定で多数の分子(本実験では最大約3億分子)の動きをシミュレートしました。その結果、(1)各分子のセルロース表面での移動軌跡、(2)時間が経過するにつれ反応速度が大きく低下する現象、(3)表面上の一分子当たりの反応速度が希薄条件下のそれより数百倍低下する現象、(4)溶液中のセルラーゼの濃度を上昇させていくと、ある一点を超えた領域で反応速度が低下する現象、を十分な精度で再現することに成功しました。ミクロな空間スケール、マクロな空間スケール、秒単位の時間スケール、時間単位の時間スケールのさまざまな角度から生化学実験と整合的な結果が得られていることから、このモデルは生化学的現象を忠実に再現していると考えられます。
このモデルを詳細に分析することにより、反応中に起きているさまざまなメカニズムが明らかになりました。セルラーゼ分子は、図(a)に示すように比較的サイズの小さいセルロース結合性ドメイン(CBD)によってセルロース基質の表面に吸着し、その後サイズの大きい触媒ドメイン(CD)が結合することにより加水分解を開始しますが、セルラーゼ分子に存在するこれら二つのドメインの大きさが重要な要因となっていることがわかりました。セルラーゼ分子の濃度が高まると、このCBDによる分子の吸着・脱離が頻繁に発生し、それが空間的に邪魔になって、図(b)に示すようにより大きなCDの結合が阻害されます。例えるならば、一人客ばかりのラーメン屋に5人組のグループで来店すると隣り合わせに着席することが難しいという状況に似ています。混雑していない時間帯であれば問題なく着席できますが、ランチの時間帯にはいつまでたっても着席できないでしょう(一人客のセルラーゼCBDは順番待ちせず後ろから平気で抜かしていきます)。これは逆に、CBDによる結合時にも空間的にもっと邪魔になるようにしてしまうことが可能であれば、つまり、一人客にも5席使わせるようにすれば、この状況は解消されることを意味しています。一見逆説的ですが、モデル上ではこれによって反応を数倍から10倍程度加速させることができることが示されました。本研究成果で得られた知見は今後の効率的なバイオマス利用に貢献すると考えられます。
本研究の一部は、文部科学省科学研究費補助金新学術領域研究「植物の力学的最適化戦略に基づくサステナブル構造システムの基盤創成」(領域代表:奈良先端科学技術大学 出村拓 教授、計画研究代表者:五十嵐圭日子)、「植物細胞壁の情報処理システム」(領域代表:東北大学 西谷和彦 教授、計画研究代表者:五十嵐圭日子)Business Finlandフィンランド卓越教授(FiDiPro)プログラム「Advanced approaches for enzymatic biomass utilization and modification(BioAd)」(五十嵐圭日子)の補助を受けたものです。
5.発表雑誌:
雑誌名:「Physical Review Letters」(オンライン版:3月6日付予定)
論文タイトル:Bridging the Micro-Macro Gap between Single-Molecular Behavior and Bulk Hydrolysis Properties of Cellulase
著者:Takahiro Ezaki*, Katsuhiro Nishinari, Masahiro Samejima, and Kiyohiko Igararashi*(*責任著者)
アブストラクトURL:
https://journals.aps.org/prl/accepted/58071YecKd41625a96bc400607db5fa9669a18e3e
6.問い合わせ先:
東京大学先端科学技術研究センター 客員研究員 江崎 貴裕(えざき たかひろ)
東京大学大学院農学生命科学研究科 准教授 五十嵐 圭日子(いがらし きよひこ)
7.添付資料:
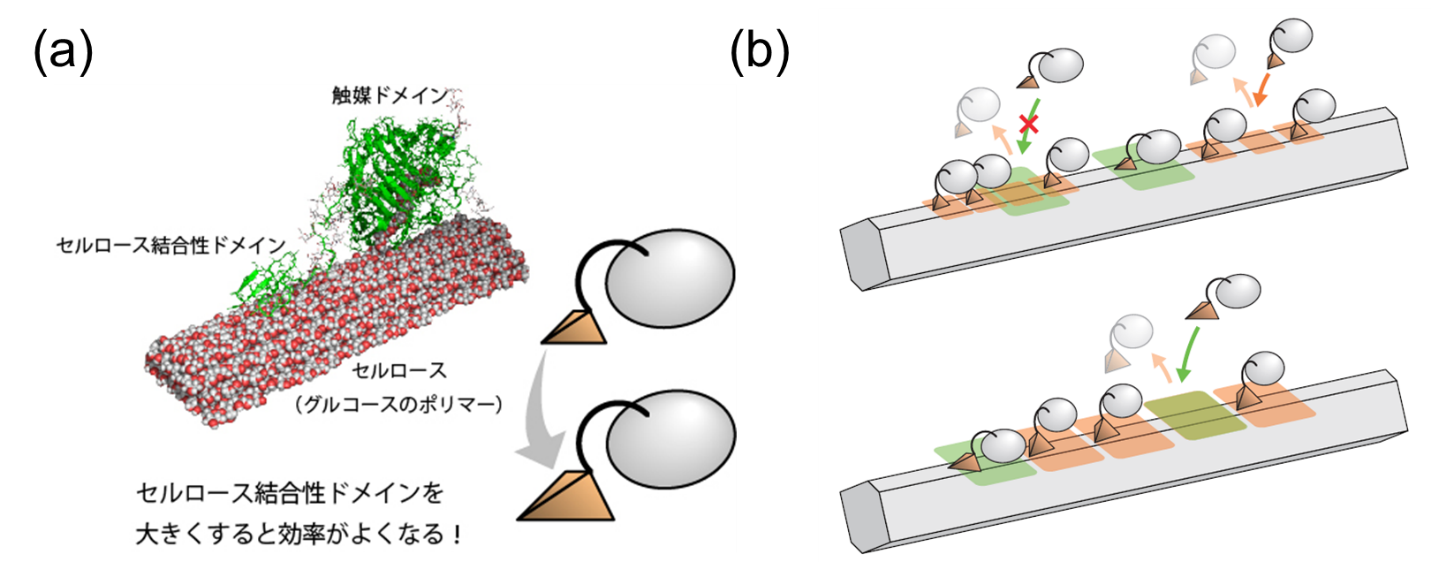
分子ドメインのサイズと混雑による反応阻害。(a) セルロース分子における触媒ドメイン(CD)とセルロース結合性ドメイン(CBD)。(b) CBDの方がCDよりも小さいと表面に吸着した他のセルロースのCBDが邪魔でCDによる反応を始めることができないが(図上)、CDのサイズが大きければ空いたスペースでCDによる結合が可能であるため反応が阻害されない(図下)。
関連タグ

