- ホーム
- 研究について
- 研究者紹介 フロントランナー
- 002:石北 央 教授
002:石北 央 教授
石北 央 教授

石北 央 教授
理論化学 分野
公開日:2019年 5月22日
タンパク質から生命の本質に迫る――
「理論で実験する」研究者が目指すこと。
生物は、進化の過程でさまざまな機能を手に入れた。タンパク質は、そうした機能を司る主要な生体分子であり、その働きを知ることは生命の本質を理解することにつながる。「理論化学分野」の石北央教授は、タンパク質の分子構造をもとに、理論計算でタンパク質の機能とメカニズムを明らかにする研究に取り組んでいる。
教授が特に力を入れているのが、植物の光合成を担うタンパク質の研究だ。だがその先に見据えているのは、生体中のタンパク質に共通する「普遍性」を見つけ出すことだ。タンパク質の働きから、生命の本質に迫る――。それが石北教授の最終目標だ。
タンパク質の働きを、理論計算によって解き明かす
植物は、太陽の光を受けて水と二酸化炭素から酸素と有機物を作り出す。光合成と呼ばれるこの働きは、現代の科学では再現できないほど高効率のエネルギー生産プロセスだ。
もし人工的に植物の光合成を再現できれば、地球上のエネルギー問題は解決すると期待されている。だが、光合成反応の詳細は解明されていないことも多く、人工光合成を産業応用できる具体的なめどは立っていない。
光合成は、大きく2つの反応に分けて考えることができる。光のエネルギーで水を分解して酸素をつくる「水分解反応」と、二酸化炭素から有機物を合成(同化)する「炭素同化反応」の2つだ。
このうち前者の「水分解反応」を担うのが、植物の葉緑体にある膜タンパク質「photosystemII(PSII)」だ。PSIIが触媒として働き、水分解反応が進んでいく。2011年になってようやく、PSIIにおける水分解反応の触媒部位の分子構造がX線構造解析によって明らかにされたが、反応メカニズムの詳細はいまだ謎に包まれている。石北教授は、その理由を次のように語る。
「PSIIは非常に複雑かつ大きな分子です。実験で反応メカニズムの詳細を見ようとしても、分子構造が複雑すぎて、どこで何が起きているかを突き止めるのは困難です。そこで私は、PSIIの分子立体構造をもとに、理論化学の手法を用いて水分解反応が起こるメカニズムの解明に取り組んでいます。タンパク質の機能とメカニズムは、その分子構造から語ることができる。どれだけ分子構造が複雑でも、その機能を基礎的な分子化学で理解することができる。私はそう考え、分子の立体構造を手掛かりに、PSIIで水分解反応が起こるメカニズムを、理論計算で明らかにすることを目指しています」
理論計算は、分子の立体構造さえダウンロードしてくれば研究を始められる。実験と比べて圧倒的にコストを抑えることができるのも大きな利点だ。
また、実験では追いきれない複雑な反応でも、理論計算であればプロセスをひとつずつ追いかけていくことができる。最終的に出た結果が、どのようなプロセスを経て導き出されたのかを突き止めることができる。そのため、計算で予想外の結果が出た場合でも、計算のプロセスを遡り、何が起きているかを明らかにできるのも、理論計算ならではのことだ。

理論計算でしかできないこと
光合成の水分解反応は、次の化学式で表すことができる。
2H2O → O2 + 4H+ + 4e
すなわち水分解反応とは、水(H2O)から水素イオン(H+)と電子(e-)を4つずつ引き抜いて、酸素(O2)を放出する反応と言うことができる。
この、水素イオンと電子を引き抜く反応は、図1に示したように4段階に分かれて進む。PSIIが触媒として働いて、この一連の反応が進んでいく。だが、反応の詳細なメカニズムは明らかにされていなかった。それは先ほども触れたように、PSIIが巨大で複雑な構造を持つため、どこで何が起きているかを実験的に突き止めるのが困難だからだ。石北教授は、その謎の解明に理論計算で挑んでいる。
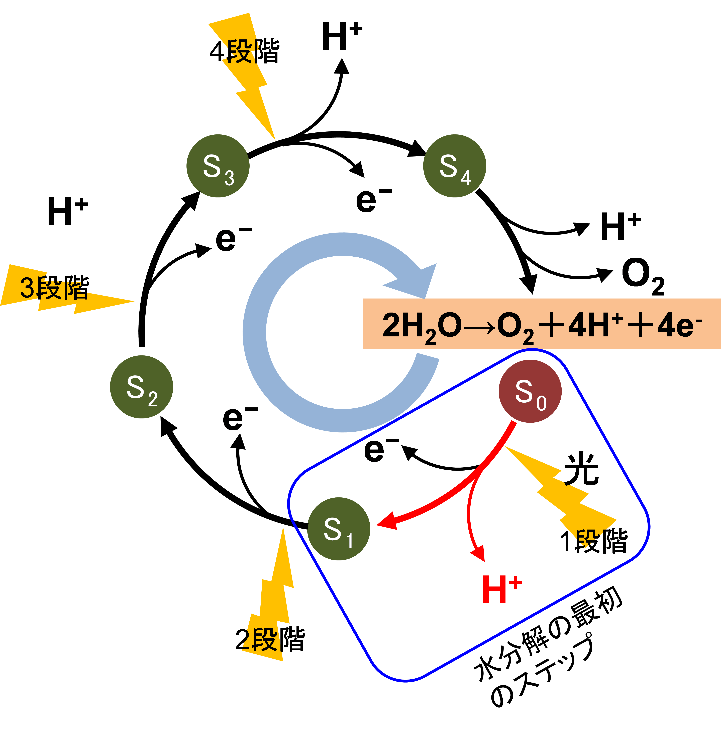
「水分解反応の詳細なメカニズムを明らかにするには、水素イオンや電子の移動経路を突き止めることが必要不可欠です。PSIIの触媒部位の分子構造は、X線構造解析によって明らかになりましたが、X線構造解析では水分解反応を追いかけることはできません」と石北教授。その理由は次のとおりだ。
「X線構造解析は、結晶化させたタンパク質の静的な構造を見る手法です。そのため、化学反応が起こって電子が動いていく様子や、反応に伴いタンパク質の形の変化を追うことはできません。さらに言えば、X線構造解析で見ているのは、原子や分子が持つ電子の状態です。電子に当たって跳ね返ったX線を計測し、計算によって分子の立体構造を導き出します。ところが、水分解反応でもっとも見たい対象のひとつである水素イオンは、単体の陽子(プロトン)そのもので電子を持っていません。そのため、X線構造解析では水素イオンを見ることができません」
水分解反応を明らかにするには、理論計算を用いるよりほか術がないのだ。
光合成の謎に、一歩ずつ迫る
PSIIにおける水分解反応の触媒部位とは、図2に示したマンガンカルシウムクラスター(Mn4CaO5錯体)のことだ。先ほども触れたとおり、2011年にクラスターの分子構造が明らかにされ、「分子構造にもとづいた水分解反応の研究が一気に勢いづきました」と石北教授は振り返る。
マンガンカルシウムクラスターは、図2にあるように「歪んだ椅子」のような特徴的な構造をしている。この「歪み」こそが水分解反応で重要な役割を果たしていると考えられている。石北教授は2013年に、「歪み」を生み出す原因原子が「背もたれ」位置にあるマンガン原子(Mn4)であることを、理論計算によって明らかにした。
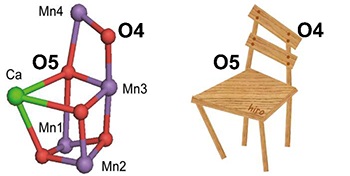
続いて石北教授は、マンガンカルシウムクラスターのどこで、最初に水素イオンが引き抜かれるかを明らかにする研究に取り組んだ。水分解反応のスタート地点を明らかにすることは、反応メカニズムの全容を知るうえでまず重要なポイントになるからだ。
「従来の説では、最初の水素イオンが発生するのは、『歪んだ椅子』の背もたれの付け根にある酸素(O5)からだと考えられていましたが、私たちは、背もたれの先端部の酸素(O4)からであることを突き止めました。従来のO5説にはいくつかの問題点があることを指摘し、O4説の方が“より自然な反応”であることを示しました」
この成果は、2015年に国際科学誌『Nature Communications』に発表され*、関連研究を活性化させた。2018年以降には、石北教授のO4説を支持する実験結果も報告された。
* 論文情報:
Keisuke Saito, A. William Rutherford, Hiroshi Ishikita, "Energetics of proton release on the first oxidation step in the water-oxidizing enzyme", Nature Communications (2015), doi:10.1038/ncomms9488 .
.
「見たいものを見る」ために、どこにフォーカスを当てるか
石北教授が光合成の一連の研究を進めるにあたり、重要なツールとして用いたのが、「量子化学計算(QM/MM法)」と呼ばれる計算手法だ。QMとは「量子力学計算(Quantum Mechanics)」を、MMとは「分子力学計算(Molecular Mechanics)」をそれぞれ表す略称で、「QM/MM法」は両者を組み合わせた計算手法である。
分子の動きや反応をシミュレーションするには、分子の構造が持つポテンシャルエネルギーを評価する必要がある。QM法を用いると、原子間の結合距離と角度を正しく求めることができる。すなわち、分子の形を正しく見ることができるが、分子が巨大になると計算コストがかさむのが弱点だ。
一方のMM法は、分子の結合の形から、簡便にポテンシャルエネルギーを計算することができる。計算コストがかさまず、速く計算できるのが利点だが、QM法よりは精度が落ちる。
QM/MM法は、両者の長所を組み合わせた。これにより、タンパク質のような巨大分子でも、実用的な精度と速度で計算することが可能になった。
この手法を開発したA. Warshel教授とM. Levitt教授は、2013年にノーベル化学賞の栄冠に輝いた。石北教授はかつて、Warshel教授のもとで研究していたことがある。
「私が学生だった十数年前は、QM法はごく小さな原子を見るのが限界でした。近年は計算機の性能も向上し、タンパク質のような巨大分子をQM法ですべて計算することもできます。ただしそれには膨大な計算コストがかかりますし、QM法の特徴を考えるとあまり賢明なアプローチではありません。QM法の計算原理になっている量子効果は、原子核や電子のスケールのごく短い距離でしか働きません。化学反応のもっとも肝になる部分に、カメラのフォーカスを当てるようにピンポイントでQM法を用い、それ以外の場所にはMM法を用いれば十分です。それを組み合わせたのがQM/MM法です。QM法のフォーカスをどこに当てて計算するかは、理論計算研究者の腕の見せ所と言えます」
光合成の水分解反応では、マンガンカルシウムクラスターが重要な働きをしているが、クラスター単独では水分解反応が起きないことも先行研究で明らかにされている。クラスターがPSIIの他の部位での反応の助けを得ながら、水分解反応を触媒しているのだ。
そこで石北教授は、クラスターにフォーカスを当ててQM法を適用し、そこから離れたところにMM法を適用した。「見たいものを見る」ために実験手法を組み立てるのと同様に、もっとも見たい反応である水素イオンの動きをクリアに見るために、「どこをどう計算するか」を考え抜いた結果である。
実験出身の理論研究者だからこそ見えること
いまは理論計算に取り組む石北教授だが、大学院生のころは実験系の研究室に所属していた。実験が大好きでひたすら研究に没頭していたという。
「そのころ取り組んでいたのは、『生体機能素子』の研究です。光のエネルギーで電子を生み出すPSIIのように、電子デバイスとして使えるタンパク質をつくり出したいと思っていました。実験そのものは楽しかったのですが、狙い通りのタンパク質をつくることができず、あくまで私個人として、実験を進めていくことへの限界も感じていました。たまたま隣の研究室が理論計算で、実験の空き時間に研究室を尋ねていろいろ教わったことが、理論の道に進むきっかけになりました。実験ではできないことも理論計算ならできると考え、博士課程でドイツに留学し、理論化学の研究室で学位を取得しました」

かつて実験に打ち込んだこの経験が、自身の研究スタイルのベースになっていると石北教授は語る。
「理論で育った研究者は、分子の理論については詳しくても、実験の研究者が実際にどのように実験を行い、どこで苦悩しているかを熟知できているわけではありません。逆もまた然りです。実験の研究者は、実際のタンパク質の取り扱いには長けていても、得られたデータの裏にある分子メカニズムを、必ずしも正しく理解できているわけではありません。私は両方の経験から、実験と理論の両方の視点を意識しつつ、“理論ツールで実験する”つもりで研究に取り組んでいます」
それがもっとも端的にあらわれるのが、実験研究者の研究成果をどう解釈するかの判断基準だ。
「理論研究は、実験から得られたタンパク質の分子構造座標からスタートします。それをどう読み解くかがまず重要です。分子構造座標は、実験データから得られる絶対的なものと思われがちですが、実験の条件やサンプルの状態などによって実験データの質にはばらつきがあります。また、データの解釈には、それぞれの実験の研究者の主観やバイアスが入ることもあります。理論研究にも限界があるように、実験で分かることにも限界があります。そのため、『実験結果』として公表されている解釈を絶対視せず、元の実験データを先入観を持たずに見つめ直す――。実験の経験があるからこそ、『実験結果』を神聖視せず、アンデルセンの童話「裸の王様」に登場する子供のように、自分が見たものを信じて研究を進め、真実に迫ることができると信じています」
これが、実験出身の理論研究者であることの強みであると言えるだろう。
学問の領域を超え、生命の本質に迫る
光合成は、「水分解反応」と「炭素同化反応」の大きく2つの反応だと冒頭で触れた。その意味での光合成能を最初に獲得したのは、30億から25億年前に出現したと考えられるシアノバクテリアだ。それが「葉緑体」として取り込まれ、植物が地球上で繁栄していった。
だが、光のエネルギーから電子を取り出す働きは、それ以前の原始的な生物も持っていたと考えられている。「光合成細菌」と呼ばれるそれらの生物は、水(H2O)ではなく硫化水素(H2S)から電子を得ていた。この光合成細菌も、植物のPSIIに相当するタンパク質を有しており、石北教授はそのタンパク質のメカニズムについても研究している。
「光合成細菌が持つタンパク質は、形も色素の流れもPSIIと非常によく似ています。ただし、電子の流れや反応機構がまったく異なります。その差を生み出すのが、マンガンカルシウムクラスターの存在です。PSIIにはクラスターが存在しますが、光合成細菌のタンパク質にはクラスターがありません。マンガンは金属です。それを獲得することで、反応機構が大きく変化したようです。両者を比較することで、クラスターの働きをより明確に説明できるようになると考えています。また、クラスターの影響で電子の移動がどう変わったかにも興味があります。大学院生のころに熱中していた『生体分子素子』の研究にもつなげていきたいところです」
さらに、石北教授の研究テーマは光合成だけにとどまらない。血圧調整酵素レニン、マウスの脳内に発現させるイオンチャネル、エイズ薬の標的であるHIVプロテアーゼなど……。いずれも生体内で働くタンパク質だ。さらには、次世代航空機材料の分子設計や、新しい理論化学研究手法の開発にも取り組んでいる。
石北教授は、なぜこれほど研究対象を広げていくのだろうか。

「光合成以外の研究が、光合成の研究に活きてきます。たとえば、PSIIより単純なタンパク質で当てはまる規則性が、PSIIにも当てはまることがあります。もっと言えば、光合成は私の重要な研究テーマのひとつですが、本当に知りたいのはタンパク質科学に共通する普遍的・本質的な真理です。タンパク質は生命にとって重要な分子です。その普遍的な現象を解明すれば、生命の本質に迫ることができます。理論化学という物理と化学の融合分野の知見を活かし、生命現象の本質を解き明かしたい。タンパク質を手掛かりに、生物と物理と化学の分野を超えた普遍的な法則に辿り着きたい。それが私の最終目標です」
実験も理論も、石北教授にとってはその最終目標を目指すためのツールでしかない。「理論で実験する」実験出身の理論研究者は、学問の領域をも超え、生命の謎に今日も挑み続けている。

2000年に東京大学大学院工学系研究科化学生命工学専攻修士課程修了後、2005年ベルリン自由大学にてPh.D.取得。ペンシルベニア州立大学博士研究員、南カルフォルニア大学博士研究員、日本学術振興会海外特別研究員を経て、2008年東京大学分子細胞生物学研究所助教。2009年に京都大学生命科学系キャリアパス形成ユニット特定助教と科学技術振興機構さきがけ研究者を兼任。2013年大阪大学大学院理学研究科生物科学専攻教授、2014年東京大学大学院工学系研究科応用化学専攻教授を経て現職。
関連タグ

