脂肪細胞ができるのを調節する新規のクロマチン構造を解明
~脂肪を蓄える遺伝子の働きを抑えるエピゲノム~
- プレスリリース
2015年11月20日
1.発表者:
松村 欣宏(東京大学先端科学技術研究センター 代謝医学分野 助教)
2.発表のポイント:
- 体の中には脂肪細胞になる前の前駆脂肪細胞が存在し、前駆脂肪細胞が脂肪細胞にならないように防いでいる仕組みを解明しました。
- 前駆脂肪細胞も脂肪細胞もゲノム配列は同じですが、前駆脂肪細胞ではエピゲノム(注1)とよばれるゲノム情報が、脂肪を蓄える遺伝子のクロマチン(注2)の構造と働きを調節していることが明らかとなりました。
- 本成果は生活習慣病の予防や新規治療法につながることが期待されます。
3.発表概要:
体の中には脂肪細胞になる前の前駆脂肪細胞が存在します。過剰に栄養を取ると、脂肪細胞は大きくなり、また前駆脂肪細胞から脂肪細胞ができます。前駆脂肪細胞も脂肪細胞もゲノムの塩基配列は同じです。しかし、前駆脂肪細胞では脂肪を蓄える遺伝子の働きが抑えられています。遺伝子の働きがそれぞれの細胞で違うのは、エピゲノムとよばれるゲノム情報によるものだと考えられていました。しかし、そのしくみは明らかではありませんでした。
東京大学先端科学技術研究センターの酒井教授、松村助教らの研究グループは、前駆脂肪細胞のエピゲノム解析を行い、新規のクロマチン構造が脂肪を蓄える遺伝子の働きを抑えていることを解明しました。本成果は生活習慣病の予防や新規治療法につながることが期待されます。
本研究は、文部科学省 科学研究費 基盤研究「エピゲノムによる肥満インスリン抵抗性の解明」、新学術領域研究「転写代謝システム」、産学連携プログラム先端融合領域イノベーション創出拠点の形成プログラム「システム疾患生命科学による先端医療技術開発」等の支援のもとで行われたものです。
本研究成果は国際科学誌『Molecular Cell』に2015年11月19日(米国東部時間)にオンライン版で発表されました。
4.発表内容:
肥満を伴うメタボリックシンドロームの発症に脂肪細胞は重要な役割を果たします。体の中には脂肪細胞になる前の前駆脂肪細胞が存在します。過剰に栄養を取ると、脂肪細胞が肥大化し、また前駆脂肪細胞から成熟した脂肪細胞ができ、余分なエネルギーを脂肪として蓄えるようになります。前駆脂肪細胞も脂肪細胞もゲノムの塩基配列は同じです。前駆脂肪細胞では脂肪を蓄える遺伝子の働きが抑えられ、脂肪細胞では遺伝子の働きが活発になっています。遺伝子の働きがそれぞれの細胞で違うのは、エピゲノムとよばれる後天的に書き換えられるゲノム情報が異なるからです。多分化能を持つ胚性幹細胞(注3)において遺伝子の働きを抑えるエピゲノムのしくみは知られていましたが、前駆脂肪細胞におけるエピゲノムのしくみは明らかではありませんでした。
今回、研究グループは前駆脂肪細胞のエピゲノム解析を行い、新規のクロマチン構造が脂肪を蓄える遺伝子の働きを抑えていることを解明しました。興味深いことに、前駆脂肪細胞では胚性幹細胞とは全く異なるエピゲノムの仕組みがあることがわかりました(図1)。
ゲノムDNAはヒストンとよばれるタンパク質により巻き取られたクロマチン構造をとって、細胞の中の核に収納されています。ゲノムの塩基配列そのものは、細胞が分裂や別の細胞へ変化しても変わりません。しかしDNAのメチル化やヒストンのメチル化といった後天的に書き変えられる遺伝情報(エピゲノム)によって、クロマチンの構造や遺伝子の働きがそれぞれの細胞において異なった制御を受けています。働きが活発な遺伝子ではクロマチンの構造が開いており、働きが抑えられている遺伝子ではクロマチンの構造が閉じています。ヒストンの一つであるヒストンH3はさまざまなメチル化を受け、遺伝子の働きに重要な役割を持っています。例えば、開いたクロマチンに存在するヒストンH3の4番目のリジンのトリメチル化 (H3K4me3、注4)は遺伝子の働きを活発に、閉じたクロマチンに存在するヒストンH3の9番目のリジンのトリメチル化(H3K9me3、注5)や27番目のリジンのトリメチル化(H3K27me3、注6)は遺伝子の働きを抑制するエピゲノムです。
生体内では、胚性幹細胞のような多分化能を持つ細胞が、さまざまな種類の前駆細胞へと運命付けられ、最終的に脂肪細胞、神経細胞、皮膚細胞など多様な細胞へと分化します。この過程においてゲノムの塩基配列は変化しませんが、エピゲノムが大きく変化し、遺伝子の働きを決めています。胚性幹細胞では活性化のH3K4me3と抑制化のH3K27me3の両方を持つクロマチン構造が約2,500の遺伝子に存在し、発生に関わる遺伝子の働きを抑えています。これは、細胞の分化にともなって速やかに必要な遺伝子の働きを活発にし、不要な遺伝子の働きを抑えるためのしくみと考えられます。
一方、生体内での脂肪組織においては、脂肪細胞だけではなく、脂肪細胞になる前の前駆脂肪細胞が存在します。しかし、前駆脂肪細胞が脂肪細胞に変化するのを抑えているエピゲノムのしくみは明らかではありませんでした。前駆脂肪細胞ではエピゲノムH3K27me3がないことから、研究グループは遺伝子の働きを抑える別のエピゲノムH3K9me3に着目し、エピゲノムH3K9me3およびそれに関わるタンパク質SETDB1(注7)がゲノム上の遺伝子配列のどこに存在するかを、次世代シークエンサー(注8)を用いてゲノムワイドに解析を行いました。その結果、前駆脂肪細胞ではエピゲノムH3K27me3の代わりに、活性化のH3K4me3と抑制化のH3K9me3が直列したクロマチン構造が約200の遺伝子に存在することがわかりました。このH3K4/H3K9me3と命名した新規のクロマチン構造は、一つの遺伝子上に開いたクロマチンと閉じたクロマチンの境界を作り、脂肪細胞分化のマスターレギュレーター(注9)と呼ばれるCebpaとPparg遺伝子の働きを抑えていることがわかりました。また、前駆脂肪細胞からSETDB1をなくすとエピゲノムH3K9me3が消失し、クロマチンの構造が開き、Cebpa, Pparg遺伝子の働きが活発になるため、前駆脂肪細胞が脂肪細胞に変化して脂肪が蓄えられることも明らかになりました。胚性幹細胞のエピゲノムH3K27me3は極めて多くの遺伝子の働きを抑えて多分化能を保つのに対し、前駆脂肪細胞のエピゲノムH3K9me3は限られた数の遺伝子の働きを抑えることにより、分化のタイミングを調節していると考えられます。< /p>今回の研究では、前駆脂肪細胞が脂肪細胞になるのをエピゲノムH3K9me3が防いでいることが明らかになりましたが、同様のしくみが神経細胞、皮膚細胞など他の前駆細胞にもある可能性があります。iPS細胞(注10)から組織を再生する際にも前駆細胞が大事な役割を持っていることから、本成果は、再生医療の分野においても非常に役立つことが期待されます。
5.発表雑誌:
論文タイトル:H3K4/H3K9me3 Bivalent Chromatin Domains Targeted by Lineage-specific DNA Methylation Pauses Adipocyte Differentiation
著者:Yoshihiro Matsumura*, Ryo Nakaki, Takeshi Inagaki, Ayano Yoshida, Yuka Kano, Hiroshi Kimura,Toshiya Tanaka, Shuichi Tsutsumi, Mitsuyoshi Nakao, Takefumi Doi, Kiyoko Fukami,Timothy F. Osborne, Tatsuhiko Kodama, Hiroyuki Aburatani, Juro Sakai* (*責任著者)
DOI番号:10.1016/j.molcel.2015.10.025
6.問い合わせ先:
教授 酒井 寿郎
7.用語解説:
(注1)エピゲノム:ゲノムの塩基配列以外の後天的に書き換えられる遺伝情報をさす。具体的にはDNAのメチル化やヒストンのメチル化など。
(注2)クロマチン:ゲノムDNAとタンパク質の複合体。ゲノムDNAはヒストンタンパク質により巻き取られたクロマチン構造をとり、細胞の中の核に収納される。
(注3)胚性幹細胞:多分化能を持つ万能性の細胞。ES細胞ともよばれる。脂肪細胞をはじめ、神経細胞、皮膚細胞などさまざまな種類の細胞に分化することができる。
(注4)ヒストンH3の4番目のリジンのトリメチル化 (H3K4me3):ヒストンH3タンパク質の4番目のリジンのトリメチル化。遺伝子の働きを活発にするエピゲノム。
(注5)ヒストンH3の9番目のリジンのトリメチル化 (H3K9me3):ヒストンH3タンパク質の9番目のリジンのトリメチル化。遺伝子の働きを抑えるエピゲノム。SETDB1が関与する。
(注6)ヒストンH3の27番目のリジンのトリメチル化 (H3K27me3):ヒストンH3タンパク質の27番目のリジンのトリメチル化。胚性幹細胞で遺伝子の働きを抑えるエピゲノム。
(注7)SETDB1:ヒストンをメチル化するエピゲノム修飾酵素。エピゲノムH3K9me3に関わる。
(注8)次世代シークエンサー:数千万のDNA断片の塩基配列を同時に決定することができる解析装置。従来のシークエンサーに比べ大幅に速く、安価に塩基配列を決定できる。
(注9) 脂肪細胞分化のマスターレギュレーター:脂肪細胞の分化を制御する主要因子。CebpaとPparg遺伝子からできるC/EBPαとPPARγタンパク質をさす。C/EBPαとPPARγタンパク質は脂肪を蓄える遺伝子の働きを活発にする。
(注10)iPS細胞:体細胞から人工的に作ることのできる多分化能を持つ細胞。人工多能性幹細胞ともよばれる。胚性幹細胞のようにさまざまな種類の細胞に分化することができ、再生医療に向けて注目されている。
8.添付資料:
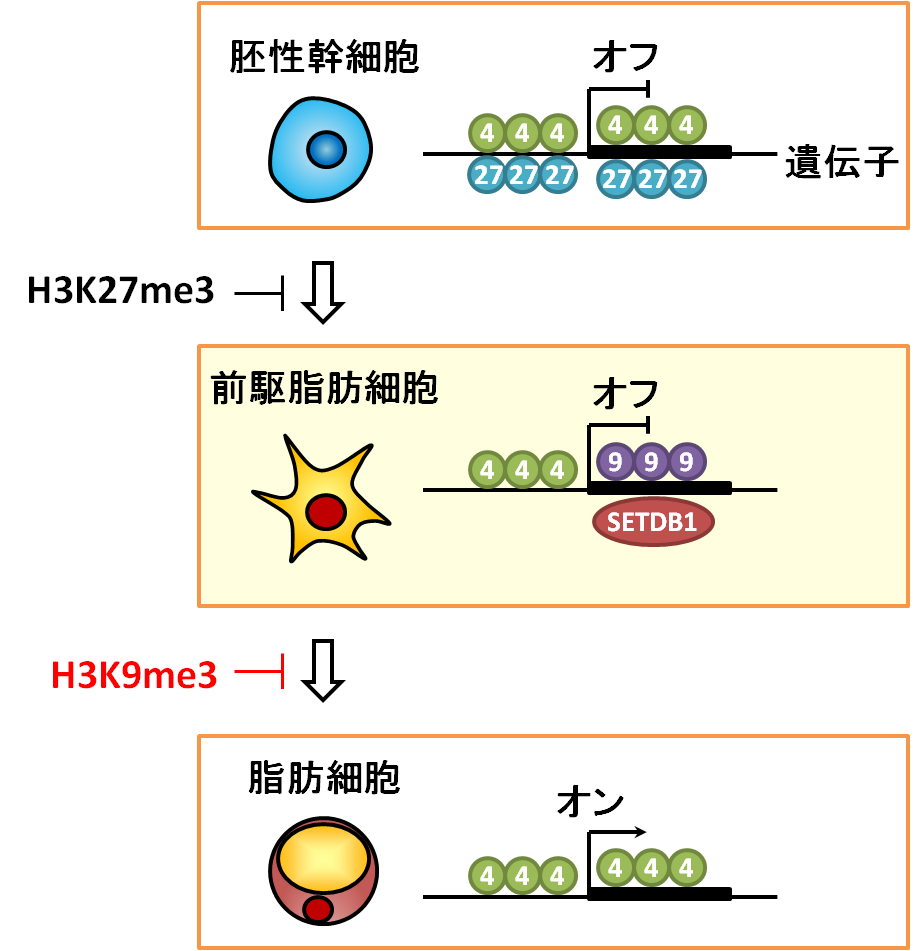
図1.脂肪細胞ができるのを防ぐエピゲノムのしくみ。
図の中の数値はトリメチル化されているヒストンH3タンパク質のリジンのアミノ酸番号を表している。胚性幹細胞ではエピゲノムH3K27me3が脂肪を蓄える遺伝子の働きを抑えるのに対し、前駆脂肪細胞ではエピゲノムH3K9me3が遺伝子の働きを抑える
関連タグ

