T細胞応答を抑制するがん代謝物(オンコメタボライト)を発見
―がん免疫療法における新規治療標的としての期待―
- プレスリリース
2023年6月6日
東京大学先端科学技術研究センター
発表のポイント
- ストレスに晒されたがん細胞が、細胞死に際してがん代謝物(オンコメタボライト)であるスペルミジンを細胞外へ放出することがわかりました。
- スペルミジンが抗腫瘍T細胞応答のネガティブレギュレーターとして機能することを明らかにしました。
- がんの進展過程で生じる組織壊死が、がんを排除するT細胞応答を抑制することで腫瘍増殖を支持している可能性が示されました。また、がん死細胞由来のスペルミジンは、がん免疫療法における新規治療標的として期待されます。
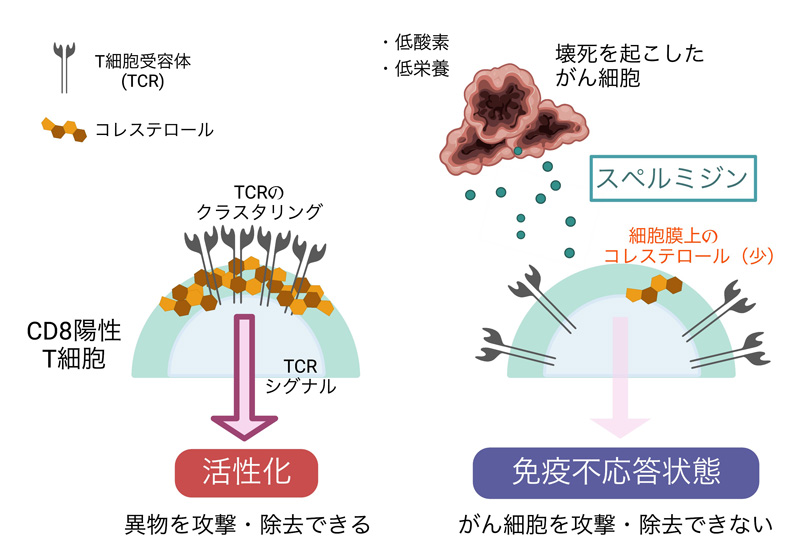
- 本研究の概略図
発表概要
東京大学先端科学技術研究センター 炎症疾患制御分野の日比野沙奈特任研究員、柳井秀元特任准教授らのグループは、同センター ニュートリオミクス・腫瘍学分野の大澤毅准教授、慶應義塾大学先端生命科学研究所の曽我朋義教授らと共同でT細胞応答を抑制するがん代謝物(オンコメタボライト(注1))を同定し、腫瘍内におけるT細胞活性制御の新しいメカニズムの解明に成功しました。CD8陽性T細胞は免疫系による腫瘍の排除において要となる細胞集団ですが、免疫抑制環境にある腫瘍組織においては、がんに対する攻撃力を失った免疫不応答状態に陥ります。研究グループは、ストレスを受けて死んだがん細胞から放出される代謝物スペルミジンが、抗腫瘍T細胞応答のネガティブレギュレーターとして機能することを見出しました。スペルミジンは生理活性ポリアミン(注2)の一種であり、がん細胞の内部に高濃度で蓄積するオンコメタボライトとしてよく知られていましたが、本研究により、免疫調節因子としてのがん細胞外因性の新たな機能が明らかになりました。本研究は、細胞外スペルミジンを標的としたがんの新たな治療戦略の開発につながることが期待されます。
本研究成果は、6月5日(米国東部夏時間 )に国際雑誌「Proceedings of the National Academy of Sciences (PNAS)」電子版に掲載されました。
発表内容
研究の背景
CD8陽性T細胞は、がん細胞を直接認識・殺傷する能力を有し、免疫系による腫瘍の排除において必須の役割を担う細胞集団です。種々のがんにおいて組織中へのCD8陽性T細胞の浸潤が確認されていますが、強力な免疫抑制環境下にある腫瘍組織においては、その多くはがんに対する攻撃力を失った免疫不応答状態に陥っています。PD-1に代表される免疫チェックポイント分子(注3)に対する阻害抗体は、T細胞の不応答性を解除し、がんを排除する免疫応答を賦活化できる治療戦略として、がん薬物治療にパラダイムシフトをもたらしました。しかしながら、その効果は特定のがん種・患者に限定的であり、腫瘍内におけるT細胞の活性制御メカニズムをより詳細に理解し、新しい治療法の開発へつなげることが急務となっています。
がん組織の内部では、不完全な血管形成に伴い、低酸素・低栄養の過酷なストレス微小環境が形成されています。その結果、広範な組織壊死(ネクローシス)が生じ、死んだがん細胞は細胞内容物を細胞外へ放出します。本研究グループでは、がん死細胞から放出される分子群の中に腫瘍免疫応答を抑制する分子が含まれることをこれまでに明らかにしてきましたが(Proc. Natl. Acad. Sci. U S A. 2016, Nat. Immunol. 2021)、抗腫瘍免疫の要となるT細胞応答に対して直接的に与える影響については解明されていませんでした。
研究の内容
研究グループは、がん死細胞のセクレトーム(分泌物)中より新規のT細胞抑制因子の探索を試みました。実験的にネクローシスを誘導したがん細胞より上清を調製し、マウスCD8陽性T細胞の培養系に添加したところ、T細胞の活性化にともなう増殖やサイトカイン(注4)の産生が顕著に抑制されることがわかりました。この解析から、抑制活性が非タンパク質性の低分子分画に存在することが明らかになり、目的分子が代謝物(メタボライト)であることが示唆されました。そこで、がん死細胞上清に対して網羅的メタボローム解析を実施したところ、オンコメタボライトとして知られるスペルミジンが候補分子として浮上しました。スペルミジンはT細胞受容体(T cell receptor: TCR)の下流近傍のシグナル伝達を阻害し、T細胞の活性化を強力に抑制することが確認され、本実験系における免疫抑制活性の本体であることが明らかになりました。続いて、スペルミジンによるT細胞抑制のメカニズムの詳細を明らかにするため、網羅的な遺伝子発現解析を実施したところ、コレステロール合成を司る遺伝子群の発現がスペルミジンの処理により大きく低下することがわかりました。コレステロールはシグナル伝達の足場構造を構成する細胞膜上脂質ラフトの主要な構成成分であり、T細胞応答においてはTCRの正常なクラスタリングに必須であることが知られています。実際に、スペルミジンを処理したT細胞では細胞膜上のコレステロール量が低下しており、活性化の際のTCRのクラスター形成の減弱が確認されました。注目すべきことに、TCRのクラスタリングやそれに引き続く下流のシグナル伝達・サイトカイン産生といったスペルミジンによる阻害が見られた事象はいずれも、培養系にコレステロールを添加することでスペルミジン未処理のT細胞と同程度にまで回復することがわかりました。以上のことから、スペルミジンによるT細胞の機能抑制はコレステロールの調節を介したものであると考えられました。
また、スペルミジンは担がんマウスモデルの腫瘍間質液中に高濃度で検出されることも見出しました。腫瘍局所における免疫応答への関与が示唆されました。そこで、がん細胞のスペルミジン合成系の阻害が抗腫瘍免疫応答に与える影響について検討を行い、ポリアミン合成系の律速酵素に対する阻害剤であるエフロルニチンを担がんマウスモデルに投与すると、CD8陽性T細胞依存的な腫瘍増殖の抑制とともに、腫瘍内のT細胞応答の活性化を誘導することができました。この時、スペルミジンを外から補充することでこの効果は打ち消されることもわかりました。また、エフロルニチンは抗PD-1抗体に抵抗性を示すマウスモデルに対しても有効であり、両者を併用すると単剤投与時に比べてより強力な抗腫瘍効果が得られることも明らかになりました。
今後の展望
本研究は、オンコメタボライトであるスペルミジンのこれまで知られていなかった新しい機能として、免疫調節因子としてのがん細胞外因性の役割を見出すことに成功しました。公共データベースの遺伝子発現データに基づく解析では、肺がんをはじめとした複数のヒトがん種において、抗腫瘍T細胞応答とポリアミン合成系の遺伝子シグネチャーの間に有意な負の相関が確認されており、本研究での細胞・マウスを用いて得られた結果を支持する知見を得られています。ポリアミン合成阻害剤等によるがん細胞のスペルミジン産生阻害は、免疫チェックポイント阻害剤に代表されるT細胞を標的としたがん免疫療法の有効性を増強させるために有望な戦略であることが期待されます。

-
図1:本研究の概略図
CD8陽性T細胞が活性化し、異物を攻撃・除去するためには、細胞膜上におけるTCRのクラスタリングや、それに引き続くTCR下流のシグナル伝達が適切に実行される必要がある(左)。腫瘍局所のストレス環境下において大規模な組織壊死が生じると、がん細胞は細胞死に際してオンコメタボライトの一つであるスペルミジンを細胞外へ放出する。スペルミジンがT細胞膜上のコレステロールを枯渇させる結果、TCRのクラスター形成が阻害され、下流のシグナル伝達にも障害が生じる。その結果、T細胞は免疫不応答状態に陥り、がんに対する攻撃力を失ってしまう(右)。
発表者
東京大学
先端科学技術研究センター
- 炎症疾患制御分野
日比野 沙奈(特任研究員)
衛藤 翔太郎(特任研究員)
半谷 匠(客員研究員)
柳井 秀元(特任准教授) - ニュートリオミクス・腫瘍学分野
菅谷 麻希(学術専門職員)
大澤 毅(准教授)
医学部
谷口 維紹(非常勤講師/東京大学名誉教授)
- 慶應義塾大学 先端生命科学研究所
遠藤 慶子(技術員)
芦谷 早苗(技術員)
曽我 朋義(教授)
論文情報
- 雑誌:
- Proceedings of the National Academy of Sciences (PNAS)
- 題名:
- Tumor cell-derived spermidine is an oncometabolite that suppress TCR clustering for intratumoral CD8+ T cell activation
- 著者:
- Sana Hibino, Shotaro Eto, Sho Hangai, Keiko Endo, Sanae Ashitani, Maki Sugaya, Tsuyoshi Osawa, Tomoyoshi Soga, Tadatsugu Taniguchi*, Hideyuki Yanai*
- DOI:
- 10.1073/pnas.2305245120
研究助成
本研究は、文部科学省科学研究費・基盤研究(A)「ダメージ関連分子による炎症・免疫応答系の制御機構の解明(課題番号:20H00504)」、基盤研究(B)「自己炎症の誘導・遷延化に関わる自己細胞由来分子群の解明(課題番号:22H02887)」、特別研究員奨励費「自己由来の免疫調節因子を起点とした腫瘍誘発性炎症の分子機序解明と治療への応用(課題番号:19J00887)」、若手研究「腫瘍由来DAMPsによるT細胞の機能不全誘導メカニズムの解明と治療への応用(課題番号:19K16736)」、「がん死細胞が放出する糖ヌクレオチドによる、T細胞の疲弊化誘導メカニズムの解明(課題番号:21K15499)」、「ダメージ関連分子による線維化制御機構の解明(課題番号:21K15465)」、日本医療研究開発機構・AMED-PRIME「細胞障害関連分子(DAMPs)が加速する炎症と免疫老化メカニズムの解明(課題番号:JP20gm6110008)」、武田科学振興財団、興和生命科学振興財団、公益財団法人がん研究振興財団、上原記念生命科学財団、金沢大学がん進展制御研究所における共同研究、北海道大学遺伝子病院制御研究所における共同研究、UTEC-UTokyo FSI Research Grant Programの支援により実施されました。
用語解説
- (注1)オンコメタボライト
がん細胞では、遺伝子変異やそれに伴うシグナル伝達の異常により、特定の代謝物(メタボライト)が細胞内に異常に蓄積することがあります。このような代謝物はオンコメタボライトと定義され、がん細胞の悪性形質の獲得に関与すると考えられています。 - (注2)ポリアミン
分子内に複数のアミノ基(-NH2)を有する脂肪族炭化水素の総称。正電荷を帯びるため、負電荷を帯びた細胞内分子(DNAやRNA、タンパク質)と相互作用し、遺伝子の転写や翻訳を調節する細胞増殖因子として機能することが知られています。 - (注3)免疫チェックポイント分子
T細胞による免疫応答を誘導するためには、T細胞受容体(TCR)下流で駆動される活性化シグナルの伝達が必要です。一方で、免疫チェックポイント分子と呼ばれる抑制性のシグナルを伝達する仕組みも存在します。T細胞の過剰な活性化や自己に対する免疫応答を防ぎ、免疫寛容を維持することが免疫チェックポイント分子の本来の役割ですが、がんの進展の過程では免疫系によるがんの排除を制限し、さらなる腫瘍増殖を助長していると考えられています。 - (注4)サイトカイン
免疫細胞をはじめとする各種細胞により産生・分泌される、免疫応答の調節因子として働くタンパク質の総称であり、細胞間の相互作用に利用されることが知られています。例えば、CD8陽性T細胞が産生するサイトカインであるIFN-やTNF-は、がん細胞に直接作用しその増殖や生存を妨げる、抗腫瘍性サイトカインとして機能すると考えられています。
問合せ先
東京大学先端科学技術研究センター 炎症疾患制御分野
特任准教授 柳井 秀元(やない ひでゆき)
関連タグ

