受容体のオンオフを制御する新たな仕組み
―立体構造解析から明らかになった脂肪酸の長さを認識する受容体の構造基盤と開発薬が作用するユニークな機序―
- プレスリリース
2025年3月26日
東京大学
東北大学
発表のポイント
- 私たちの健康に重要な働きを持つ短鎖脂肪酸受容体(FFA2)について、クライオ電子顕微鏡を用いて、作動薬と遮断薬がそれぞれ結合したFFA2の立体構造を解明しました。
- FFA2が短い脂肪酸のみを選択的に認識する仕組みを突き止めるとともに、FFA2を標的とする開発薬が予想外の部位に結合してFFA2の機能を制御する新たなメカニズムを発見しました。
- この研究成果は、生活習慣病や炎症性腸疾患に対する、より有効性の高い新規治療薬の開発につながることが期待されます。
概要
私たちの健康維持に重要な働きを担う短鎖脂肪酸(注1)は、食物繊維が腸内細菌によって分解されることで作られる物質です。この短鎖脂肪酸は、私たちの腸や脂肪組織、膵臓、免疫細胞の細胞膜上に存在する短鎖脂肪酸受容体(FFA2)(注2)を介して、代謝や免疫の制御など、様々な生理作用を引き起こします。近年、FFA2は生活習慣病や炎症性腸疾患(注3)の治療標的として大きな注目を集めており、すでに複数の治療薬候補化合物が開発され、一部は臨床試験にも進んでいます。しかし、FFA2がどのように短鎖脂肪酸を選択的に認識し、またFFA2を標的とするこれら開発薬がどのようにその機能を制御するのかは不明でした。
東京大学大学院理学系研究科生物科学専攻(東京大学先端科学技術研究センター兼任)の九川真衣大学院生、東京大学先端科学技術研究センターの川上耕季東京大学特別研究員、同(大学院理学系研究科生物科学専攻兼任)加藤英明教授、東北大学大学院薬学研究科の木瀬亮次特任助教、井上飛鳥教授(京都大学大学院薬学研究科兼任)らの研究グループは、クライオ電子顕微鏡(注4)を用いて、作動薬(注5)が結合した活性化型FFA2と、遮断薬(注6)が結合した不活性化型FFA2の2種類の立体構造を決定することに成功しました。得られた構造を精査したところ、FFA2を標的とする開発薬である作動薬4-CMTBと遮断薬GLPG0974が、これまで予想されていた場所とは異なる位置に結合することを見出しました。さらに、分子動力学シミュレーション(注7)や機能解析実験を用いることで、FFA2が短鎖脂肪酸を選択的に認識する仕組みを解明するとともに、新しい作動・遮断機構によってFFA2の機能を制御することを明らかにしました。
本研究成果は、FFA2を標的とするより効果的な治療薬の設計につながり、生活習慣病や炎症性腸疾患の新しい治療薬開発を加速させることが期待されます。さらに、本研究で得られた作動薬・遮断薬の作用機構の情報は、FFA2以外の他の受容体に対する薬剤開発へ応用できる可能性があり、今後、様々な疾患に対する革新的な治療薬の開発が進むことが期待されます。
本研究成果は、2025年3月26日(英国標準時)に英国科学誌「Nature Communications」のオンライン版に掲載されました。
発表内容
脂質は、私たちの体においてエネルギー源や細胞膜の構成成分としての役割を担うだけでなく、細胞に様々な指令を伝えるシグナル分子としても機能します。特に、細胞膜上に存在するGタンパク質共役受容体(GPCR)(注8)と呼ばれるタンパク質ファミリーは、多様な脂質を認識し、細胞内の三量体Gタンパク質(注9)を介して細胞の機能を調節しています。ヒトには約40種類の脂質受容体が存在し、骨や血管の形成・発達から疼痛の制御、免疫調節、脳機能調節、代謝調節に至るまで、多岐に渡る生理機能に関わっています。
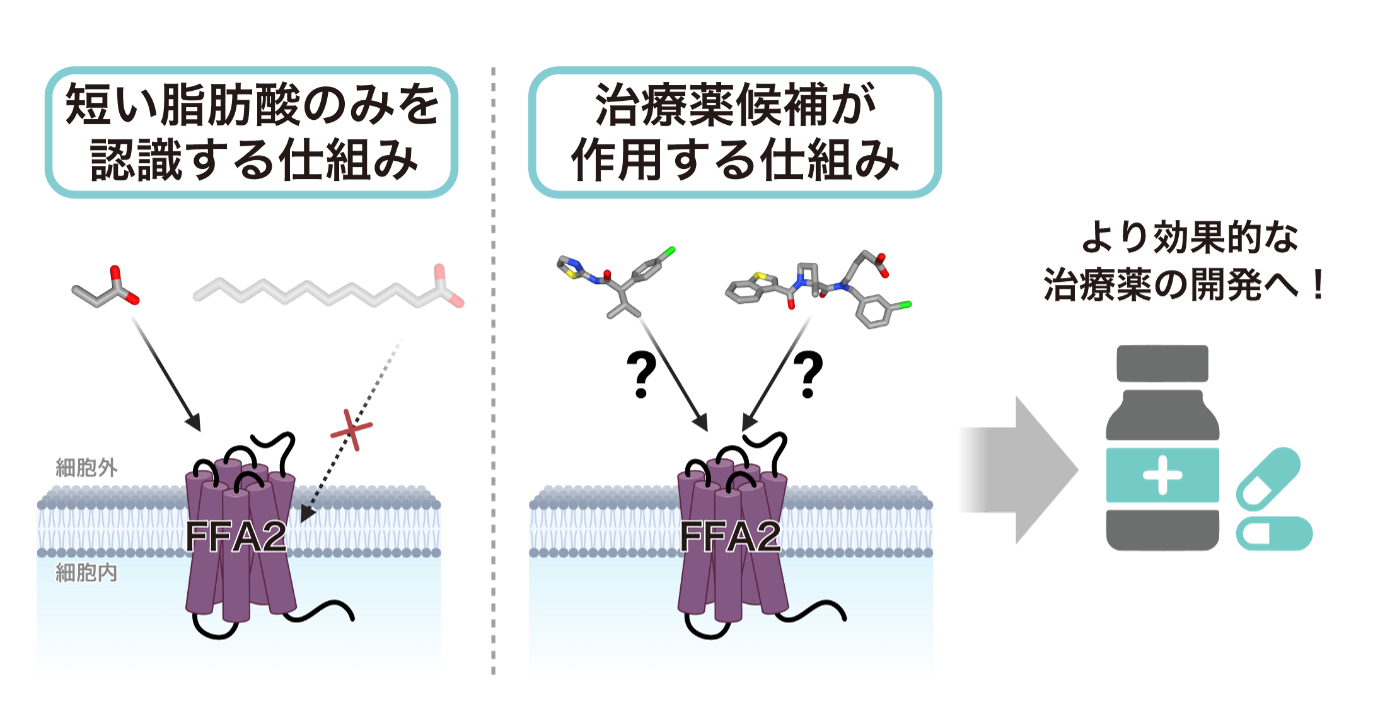
これらの脂質受容体の中でも、とりわけ遊離脂肪酸受容体(FFAR)は特徴的な脂質受容体です。ヒトには4種類のFFAR(FFA1-FFA4)が存在し、それぞれ異なる長さの遊離脂肪酸を認識します。例えば、FFA1とFFA4は長鎖脂肪酸(注10)を、FFA2とFFA3は短鎖脂肪酸を主に感知します。一方、どのような受容体の構造基盤により脂肪酸鎖長の違いを見分けることができるのか、これまで不明でした。
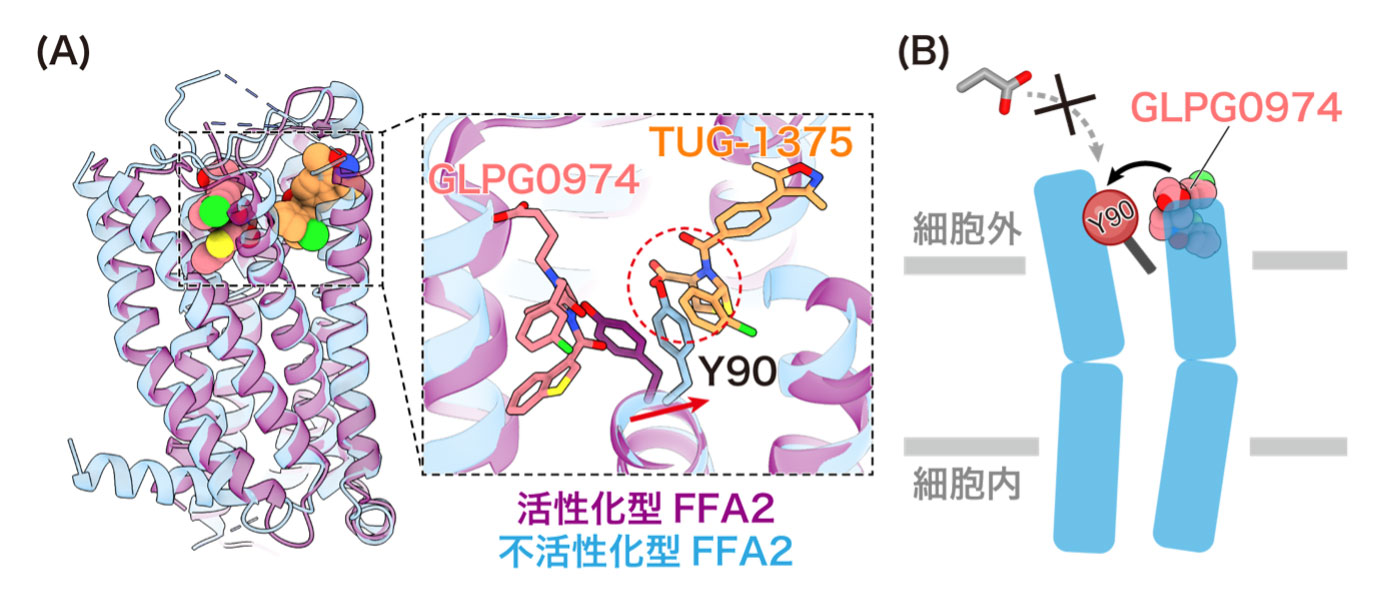
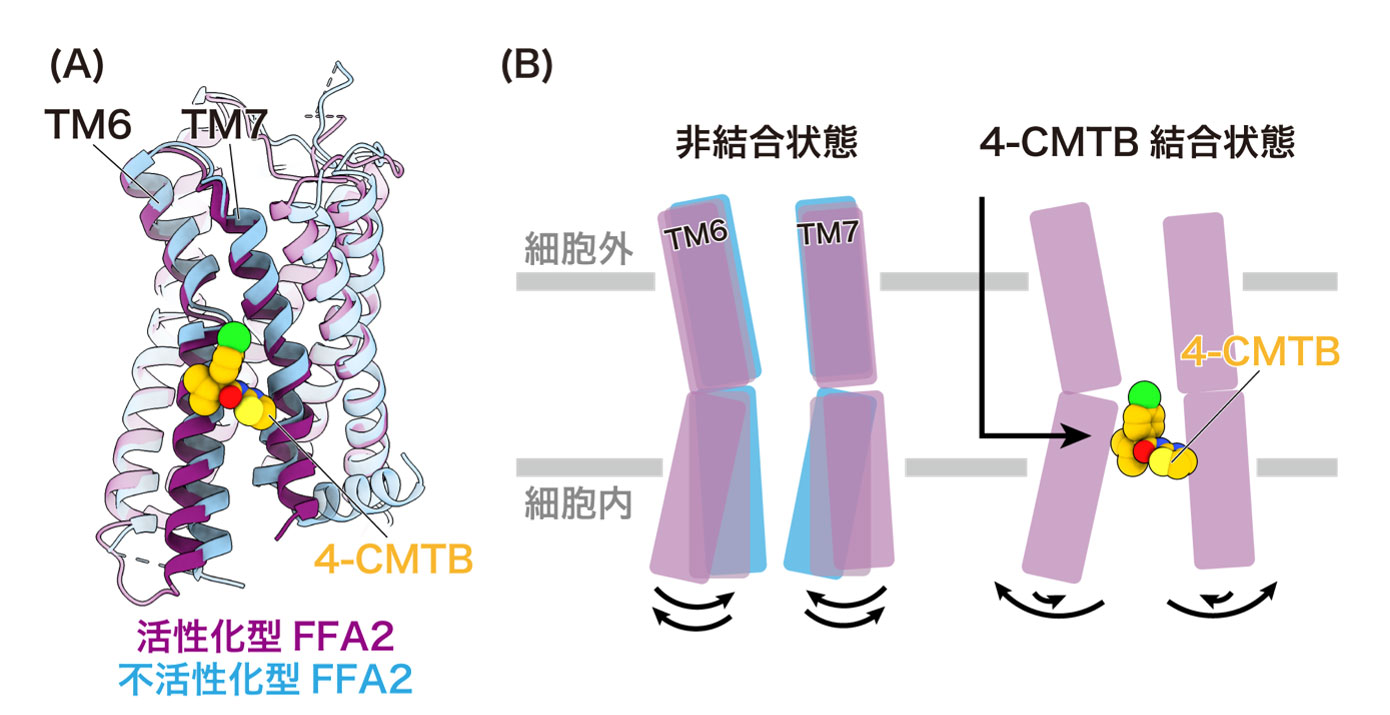
4種類のFFARの中でもFFA2は、腸内細菌が作り出す短鎖脂肪酸を認識して、免疫機能や代謝機能の調節を行うことから、炎症性腸疾患や生活習慣病の治療標的として注目を集めています。すでに複数の治療薬候補化合物が開発されており、炎症性腸疾患の開発薬として過去に臨床試験が行われている遮断薬GLPG0974(注11)は、その代表例です。GLPG0974はFFA2の機能を抑制する効果を持つことが報告されていますが、その詳細なメカニズムは不明でした。また、作動薬4-CMTB(注12)は、短鎖脂肪酸とは異なるメカニズムでFFA2を活性化することが報告されているものの、具体的にどのようにしてFFA2を活性化するのかは全く明らかにされていませんでした。
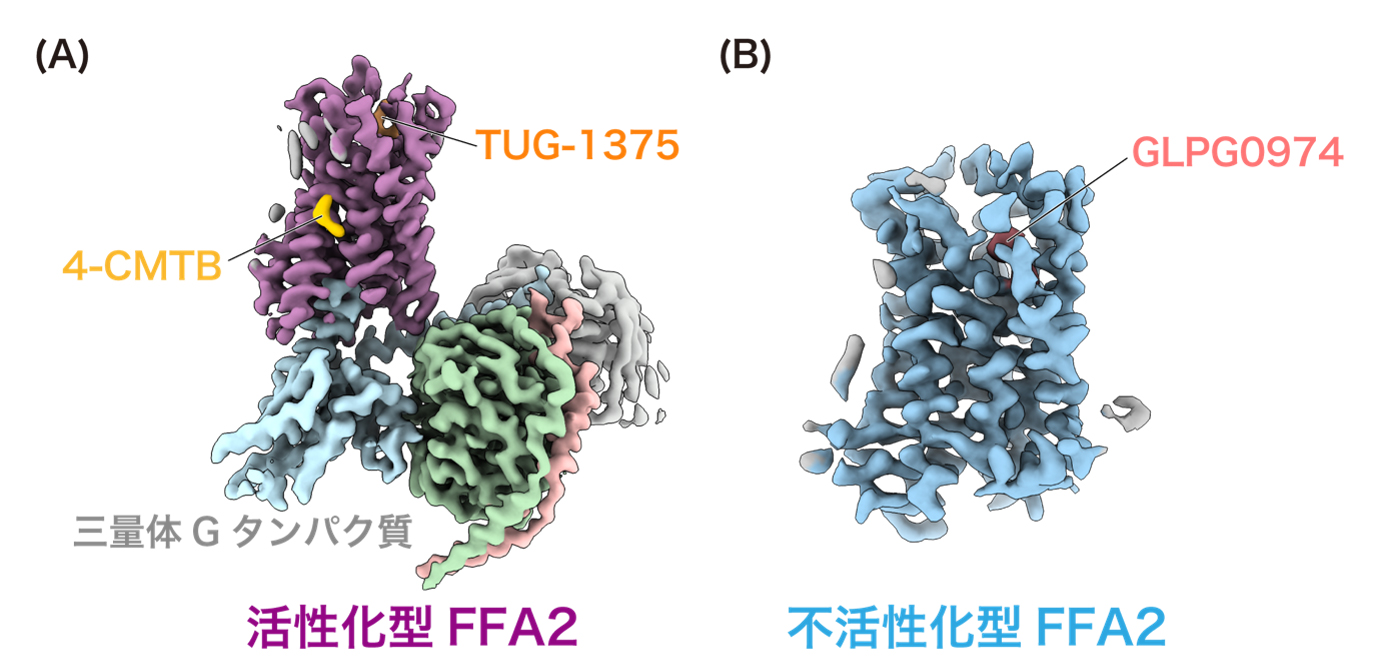
本研究グループは、クライオ電子顕微鏡を用いて、FFA2を活性化する2つの作動薬(TUG-1375と4-CMTB)が結合した活性化型FFA2(細胞内側に三量体Gタンパク質が結合した状態)と、遮断薬GLPG0974が結合した不活性化型FFA2の計2種類の立体構造を、それぞれ3.19 Å、3.36 Åの分解能で決定することに成功しました(図1)。得られた立体構造をもとに、分子動力学シミュレーションや機能解析実験を行うことで、FFA2が短鎖脂肪酸を選択的に認識する仕組みや、FFA2を標的とする化合物がFFA2の機能をどのように制御しているかを調べました。
(A) 作動薬TUG-1375と4-CMTBが結合した活性化型FFA2(細胞内側に三量体Gタンパク質が結合した状態)
(B) 遮断薬GLPG0974が結合した不活性化型FFA2のクライオ電子顕微鏡マップ
この仮説を検証するために、本研究グループはFFA2の特定のアミノ酸を別のアミノ酸に置き換えることで、FFA2に対して細胞膜に向かって開いた入口を人工的に作り出しました。その結果、細胞膜に向かって開いた入口を持つように改変したFFA2は、本来は認識できないはずの長鎖脂肪酸も認識できるようになりました(図2B)。この実験結果は、FFA2とFFA1が遊離脂肪酸の入口の位置の違いによって、短鎖脂肪酸と長鎖脂肪酸をそれぞれ選択的に認識することを裏付けました。

(A) FFA2とFFA1 (PDB ID: 8EJC) のサーフェスモデルの比較 (B) 長鎖脂肪酸によるGPCR活性化能の評価
(A) 活性化型FFA2と不活性化型FFA2の重ね合わせ図 (B) GLPG0974の不活性化メカニズムの模式図
(A) 活性化型FFA2と不活性化型FFA2の重ね合わせ図 (B) 4-CMTBによる活性化メカニズムの模式図
〈今後の展望〉
本研究では、クライオ電子顕微鏡を用いて、FFA2の立体構造を活性化型と不活性化型の両方で決定することに成功しました。その結果、FFA2が巧妙な仕組みによって短鎖脂肪酸を選択的に認識することや、FFA2を標的とする開発薬である遮断薬GLPG0974と作動薬4-CMTBがこれまでに報告のない新しい仕組みでFFA2の機能を制御することを明らかにすることができました。
本研究成果は、FFA2を標的とするより効果的な治療薬の開発において重要な手がかりとなり、炎症性腸疾患や生活習慣病の新しい治療薬開発を加速させることが期待されます。さらに、本研究で得られた知見は、FFA2以外の他の受容体に対する薬剤開発にも応用できる可能性があります。今後、様々な疾患に対する革新的な治療薬の開発が一層進展することが期待されます。

-研究者からのコメント-
FFA2は代謝・免疫機能を制御する重要な膜受容体であり、最近では腸内細菌叢―宿主間のコミュニケーションにおける玄関口としても注目を集めています。今回我々が明らかにしたFFA2によるリガンド認識機構やリガンドによるFFA2の活性制御機構は、従来の活性制御機構とは異なるユニークなものであり、この知見を利用することで今後FFA2や類似の膜受容体を標的とした創薬が加速すると期待されます。(東京大学先端科学技術研究センター 加藤英明教授)
発表者・研究者等情報
東京大学
先端科学技術研究センター
加藤 英明 教授
兼:同大学大学院理学系研究科 教授
川上 耕季 東京大学特別研究員(日本学術振興会特別研究員-PD)
石北 央 教授
兼:同大学大学院工学系研究科 教授
大学院工学系研究科
辻村 真樹 博士課程(日本学術振興会特別研究員)
大学院理学系研究科
九川 真衣 博士課程
東北大学
大学院薬学研究科
井上 飛鳥 教授
兼:京都大学大学院薬学研究科 教授
木瀬 亮次 特任助教
Stanford大学
Department of Computer Science
Ron Dror Professor
Carl-Mikael Suomivuori Senior Scientist
論文情報
- 雑誌名: Nature Communications
- 題 名:Structural insights into lipid chain-length selectivity and allosteric regulation of FFA2
- 著者名:Mai Kugawa, Kouki Kawakami, Ryoji Kise, Carl-Mikael Suomivuori, Masaki Tsujimura, Kazuhiro Kobayashi, Asato Kojima, Wakana J. Inoue, Masahiro Fukuda, Toshiki E. Matsui, Ayami Fukunaga, Junki Koyanagi, Suhyang Kim, Hisako Ikeda, Keitaro Yamashita, Keisuke Saito, Hiroshi Ishikita, Ron O. Dror, Asuka Inoue* & Hideaki E. Kato*
- DOI:10.1038/s41467-025-57983-4
研究助成
本研究は、「Interdisciplinary Computational Science Program in CCS」、「JSPS KAKENHI (課題番号: JP23KJ0363, JP24K18286, JP22KJ1109, JP23H04963, JP24K01986, JP23H02444, JP21H04791, JP21H05113, JP21H05037, JP21H04791, JP21H05142)」、「JST SPRING (課題番号: 246100000199)」、「JST FOREST (課題番号: JPMJFR215T, JPMJFR204S)」、「JST CREST (課題番号: JPMJCR21P3, JPMJCR23B1)」、「JST moonshot R&D (課題番号: JPMJMS2023)」、「AMED (課題番号: JP22ama121038, JP22zf0127007, 24bm1123057h0001)」、「the Human Frontier Science Program (HFSP) (課題番号: LT000916/2018-L, RGP019/2024)」、「National Institutes of Health (NIH) (課題番号: R01GM127359)」、「千里ライフサイエンス振興財団」、「上原記念生命科学財団」の支援により実施されました。
用語解説
- (注1)短鎖脂肪酸
2-6個の炭素からなる脂肪酸。腸内細菌が食物繊維を分解する過程で産生される。酪酸、プロピオン酸、酢酸などが代表的な短鎖脂肪酸である。 - (注2)短鎖脂肪酸受容体(FFA2)
腸内細菌が産生する短鎖脂肪酸を認識する受容体の一つ。腸管上皮細胞、免疫細胞、脂肪細胞、膵臓β細胞など、様々な組織に発現しており、免疫系の制御や代謝の調節に重要な役割を果たしている。 - (注3)炎症性腸疾患
腸に炎症を起こす病気の総称。主な症状として腹痛や下痢が見られ、潰瘍性大腸炎やクローン病がこれに含まれる。 - (注4)クライオ電子顕微鏡
2017年にノーベル化学賞を受賞した技術。極低温環境でタンパク質試料に電子線を照射し、その投影像から立体構造を計算して求める手法。この手法によって、タンパク質の構造解析にかかる時間が大幅に短縮され注目を集めている。 - (注5)作動薬
受容体に結合してその機能を活性化する物質。私たちの体の中には様々な受容体が存在しており、それらの機能を活性化する作動薬は多くの病気の治療薬として使われている。 - (注6)遮断薬
受容体に結合してその機能を抑制する物質。受容体の働きが過剰な場合に、その機能を抑制するために治療薬として使用される。 - (注7)分子動力学シミュレーション
コンピュータを使って原子レベルでの分子の動きを再現・解析する手法。実験では直接観察することが難しい、タンパク質の動的な振る舞いを理解することができる。 - (注8)Gタンパク質共役受容体(GPCR)
細胞膜を7回貫通する構造を持つ受容体タンパク質。ホルモンや神経伝達物質など、様々な生理活性物質の信号を細胞内に伝える。ヒトでは約800種類のGPCRが存在し、現在使用されている医薬品の約3分の1がGPCRを標的としている。 - (注9)三量体Gタンパク質
3つのサブユニットからなるタンパク質で、活性化した受容体と結合して情報を細胞内に伝える働きを持つ。細胞の機能を適切に制御するために重要な役割を果たしている。 - (注10)長鎖脂肪酸
14個以上の炭素からなる脂肪酸。動物性脂肪や植物油に多く含まれる。パルミチン酸やオレイン酸などが代表的な長鎖脂肪酸である。 - (注11)GLPG0974
炎症性腸疾患の治療薬候補として開発された化合物。FFA2の機能を抑制することで、過剰な炎症反応を抑える効果が期待される。 - (注12)4-CMTB
FFA2を活性化する効果を持つ化合物。基礎研究において、FFA2の機能を研究するためのツールとして広く使用されている。
問合せ先
東京大学 先端科学技術研究センター
教授 加藤 英明(かとう ひであき)
関連タグ